Tabla de Contenidos
Un ion espectador es toda aquella especie química cargada eléctricamente que aparece entre los reactivos y de nuevo en los productos de la reacción cuando esta se escribe en forma de ecuación iónica. En otras palabras, son iones que no sufren ningún tipo de transformación durante una reacción química, pero que sí están presentes durante la misma.
Es común que en las reacciones químicas que involucran compuestos iónicos solo intervengan directamente algunos de los iones presentes en la solución. Aquellos que no intervienen directamente en la reacción química son los iones espectadores.
Cómo reconocer a un ion espectador en una reacción química
Cuando representamos las reacciones químicas entre compuestos iónicos en forma de ecuaciones moleculares puede resultar difícil reconocer de manera rápida a los iones espectadores. De hecho, incluso puede ser difícil reconocer cuáles son los iones involucrados en la reacción.
Una ecuación molecular es una ecuación química en la que se representan todas las especies por medio de sus fórmulas empíricas o moleculares neutras como si todas se trataran de compuestos moleculares (a pesar de que los compuestos iónicos no son, por su puesto, compuestos moleculares). Las ecuaciones moleculares tienen el beneficio de que hacen más fáciles los cálculos estequiométricos, sin embargo, representan de forma errónea cómo realmente ocurren las reacciones entre iones. Para ello existen otros dos tipos de ecuaciones químicas que son las ecuaciones iónicas y las ecuaciones iónicas netas.
La ecuación iónica total y la ecuación iónica neta
Identificar los iones espectadores es muy fácil cuando se una reacción se escribe en forma de su ecuación iónica y de su ecuación iónica neta. Esto se debe a que los iones espectadores son, simplemente, aquellos que aparecen en la ecuación iónica total pero no en la ecuación iónica neta.
Pasos para escribir la ecuación iónica neta
Para mostrar cómo escribir las ecuaciones iónicas y reconocer en ellas a los iones espectadores, consideremos como ejemplo la reacción entre el nitrato de plomo (II) (Pb(NO3)2) y el yoduro de potasio (KI) para formar yoduro de plomo (II) (PbI2) que precipita en forma sólida y nitrato de potasio (KNO3) que permanece en solución.
A continuación, se describen los pasos para obtener la ecuación iónica neta de esta y de cualquier otra reacción, y, en el proceso, reconocer a los iones espectadores involucrados.
- Paso 1: Escribir y balancear la ecuación molecular
En el caso del ejemplo que estamos utilizando, la reacción es:

- Paso 2: Separar todos los compuestos iónicos que estén en solución en sus iones constituyentes escribiéndolos entre corchetes. Esto no se hace con los compuestos iónicos que estén en estado sólido.
En nuestro ejemplo, esto implica ionizar al nitrato de plomo (II), al nitrato de potasio y al yoduro de potasio, ya que todos se encuentran en solución (de allí el subíndice ac.) pero no al yoduro de plomo (II), ya que este se encuentra en estado sólido.
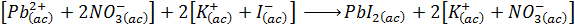
- Paso 3: Multiplicar todos los iones por los coeficientes estequiométricos para obtener así la ecuación iónica total.
La finalidad de este paso es eliminar los corchetes y separar todos los iones para escribirlos de forma independiente, tal como están realmente en solución:
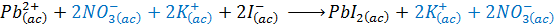
Esta es la ecuación iónica total de la reacción. Muestra a todos los iones que se encuentran presentes durante la reacción química. Nótese que los iones resaltados en azul (los iones potasio y nitrato) aparecen tanto en los reactivos como en los productos inalterados.
- Paso 4: Cancelar o eliminar todos los iones que se repitan en los reactivos y en los productos.
En este caso, se trata de los iones resaltados en color azul en la ecuación iónica total, es decir, los iones potasio y nitrato.
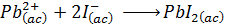
Esta representa la ecuación iónica neta de la reacción, y, por lo tanto, muestra la reacción química que realmente está ocurriendo, es decir, la precipitación de los iones plomo (II) y yoduro en forma de yoduro de plomo (II) sólido.
Al observar la diferencia entre la ecuación iónica neta y la ecuación iónica total queda mucho más claro el concepto de ion espectador. Los iones potasio y nitrato no participan en la reacción química, la cual involucra únicamente al plomo y al yoduro.
Sin embargo, no es posible tener una solución que solo contenga iones plomo (II) y otra que solo tenga iones yoduro y que se mezclen para que ocurra la reacción que se presenta en la ecuación iónica neta. Para tener iones plomo (II) en solución, necesariamente debe haber un contraión que mantenga la neutralidad de la solución. En este caso, los iones nitrato. Lo mismo sucede con el ion yoduro y los iones potasio.
Ejemplos de iones espectadores
A continuación se presentan algunos ejemplos adicionales de reacciones químicas entre compuestos iónicos en las que se identifican los iones espectadores por medio de la ecuación iónica total.
Ejemplo 1: Reacción entre el coluro de bario y el sulfato de sodio
La ecuación molecular balanceada es:

La ecuación iónica total es:
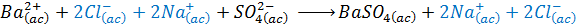
La ecuación iónica neta es:
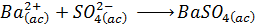
Los iones espectadores en este caso son el catión sodio (Na+) y el anión cloruro (Cl–).
Ejemplo 2: Reacción entre el nitrato de calcio y el fosfato de potasio
La ecuación molecular balanceada es:

La ecuación iónica total es:
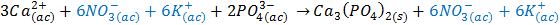
La ecuación iónica neta es:
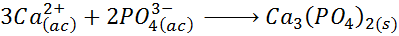
Los iones espectadores en este caso son el catión potasio (K+) y el anión nitrato (NO3–).
Ejemplo 3: Reacción de óxido reducción entre el cinc y el sulfato de cobre (II)
La ecuación molecular balanceada es:

La ecuación iónica total es:

La ecuación iónica neta es:

En este caso el único ion espectador es el anión sulfato (SO4–).
Ejemplo 4: Disolución de magnesio metálico con ácido clorhídrico
La ecuación molecular balanceada es:

La ecuación iónica total es:

La ecuación iónica neta es:

En este caso el único ion espectador es el anión cloruro (Cl–).
Referencias
- BBC Bytesize (s.f.). Ionic equations and spectator ions. Recuperado de https://www.bbc.co.uk/bitesize/guides/zsmgpbk/revision/5
- Chang, R., Manzo, Á. R., López, P. S., & Herranz, Z. R. (2020). Química (10ma ed.). New York City, NY: MCGRAW-HILL.
- Escribiendo y balanceando las ecuaciones químicas. (2020, October 30). Recuperado de https://espanol.libretexts.org/@go/page/1818
- Khan Academy (s.f.). Ecuaciones iónicas netas e iónicas completas. Recuperado de https://es.khanacademy.org/science/ap-chemistry-beta/x2eef969c74e0d802:chemical-reactions/x2eef969c74e0d802:net-ionic-equations/a/complete-ionic-and-net-ionic-equations



