Tabla de Contenidos
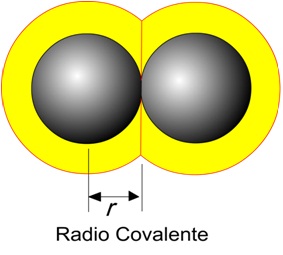
Begrebet kovalent radius er relateret til størrelsen af et atom, når det er en del af en kovalent binding med et andet atom. Som det ses på figuren, er den kovalente radius defineret som halvdelen af afstanden mellem kernerne i de to atomer, der deler en kovalent binding. Kovalent radius udtrykkes i enheder af picometer (pm) eller ångstrøm (Å) (1 Å = 100 pm). Fordi et atoms kovalente radius er defineret ud fra dets association med andre atomer, er dets værdi ikke unik og vil afhænge af dets binding med andre atomer; Som vi vil se senere, er den kovalente radius af et grundstof anderledes, hvis det er kombineret med en enkelt kovalent binding eller med en dobbelt eller tredobbelt kovalent binding.
Atomradius, ionradius, metallisk radius og kovalent radius
Begrebet atomradius af et grundstof er forbundet med afstanden mellem dets kerne og de fjerneste elektroner. Atomets form kan ændre sig ved binding med andre atomer, så atomradius er ikke en konsekvent defineret fysisk parameter, og derfor defineres forskellige radier afhængig af atomets kemiske binding. Generelt kan et kemisk grundstofs atomradius defineres som halvdelen af afstanden mellem dets kerne og det af et andet atom, som det er kemisk bundet til.. Som vi allerede har set, er den kovalente radius defineret på samme måde som den atomare radius, når atomet er forbundet med en kovalent binding, og den ioniske radius vil være den atomare radius, når atomet etablerer en ionbinding, som i et krystalgitter af et salt. På samme måde er den metalliske radius defineretsom atomradius, når atomerne er forbundet med en metallisk binding. For eksempel, i tilfælde af natrium (Na), er den atomare radius 180 pm, den kovalente radius er 154 pm, og den metalliske radius er 186 pm. I tilfælde af calcium (Ca) er den atomare radius også 180 pm, den kovalente radius med en enkeltbinding er 174 pm, den kovalente radius med en tredobbelt binding er 133 pm, og den metalliske radius er 197 pm. Et andet eksempel er jern (Fe), hvis atomradius er 140 pm, den kovalente radius med en enkeltbinding er 125 pm, den kovalente radius med en tredobbelt binding er 102 pm, og den metalliske radius er 126 pm.
Kilder
- Pyykko, P., Atsumi, M. Molecular Single-Bond Covalent Radii for Elements 1-118 . Kemi: A European Journal 15: 186–197, 2009. doi: 10.1002/chem.200800987
- Sanderson, R.T. Elektronegativitet og obligationsenergi . Journal of the American Chemical Society 105 (8): 2259–2261, 1993. doi: 10.1021/ja00346a026



