Tabla de Contenidos
La reacción de Cannizzaro es un ejemplo de una reacción orgánica de desproporción o dismutación en la cual un aldehído carente de hidrógenos alfa se oxida y reduce a sí mismo para transformarse en una molécula de ácido carboxílico y otra de alcohol. La reacción se cataliza por bases fuertes como el hidróxido de sodio o de potasio, aunque algunos alcóxidos orgánicos también se pueden utilizar como catalizadores.
Esta reacción fue descubierta y caracterizada por el químico italiano Stanislao Cannizzaro en 1853, y tiene la particularidad de que involucra la migración de un grupo hidruro desde una molécula de aldehído hasta el carbonilo de otra molécula de aldehído, efectivamente reduciendo a la segunda mientras la primera se oxida.
Sustratos de la reacción de Cannizzaro
Una condición importante para que se pueda dar la reacción de Cannizzaro es que el aldehído que reacciona no posea hidrógenos alfa. De hecho, Cannizzaro descubrió la reacción utilizando benzaldehído, un aldehído aromático que consiste en un grupo formilo unido directamente a un anillo bencénico (por lo que el carbono alfa pertenece al anillo).
Esta limitación se debe principalmente a que la reacción se cataliza por una base fuerte. De tener hidrógenos alfa, es mucho más probable que la base arranque dicho hidrógeno llevando al enolato y a otra serie de posibles productos, a que se dé la reacción de Cannizzaro.
También se debe mencionar que, a pesar de que la reacción se clasifica formalmente como una desproporción (lo que significa que un compuesto se oxida y reduce a sí mismo), la reacción de Cannizzaro también se puede llevar a cabo de forma cruzada, haciendo reaccionar dos aldehídos diferentes de tal manera que uno de ellos reduzca al otro.
Esto resulta importante desde el punto de vista de los rendimientos de reacción. Los rendimientos están limitados al 50% en el caso de la desproporción, ya que se necesitan dos moléculas de reactante por cada molécula de producto diferente.
Mecanismo de reacción
Existen dos mecanismos aceptados para la reacción de Cannizzaro. Ambos son muy similares e implican una migración de ion hidruro, pero se diferencian en cuanto a la cinética que siguen. Cuál de los dos mecanismos sigue la reacción dependerá de la concentración de la base. Estos mecanismos se presentan a continuación:
Mecanismo de la reacción de Cannizzaro a baja concentración de base
Paso 1: Ataque nucleofílico de la base al carbono carbonílico

El carbono carbonílico de los aldehídos siempre es un buen sustrato para un ataque nucleofílico; los grupos hidróxido, además de ser buenas bases, también son buenos nucleófilos.
Paso 2: Migración de ion hidruro a la segunda molécula de aldehído
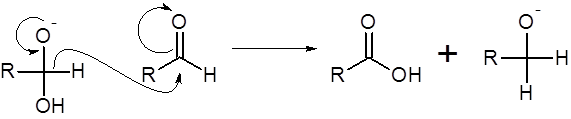
Esta es la etapa que caracteriza a la reacción de Cannizzaro. En este paso, uno de los tres pares de electrones sin compartir del átomo de oxígeno negativo cierra nuevamente el enlace doble con el carbono. Sin embargo, para que esto suceda necesariamente debe romperse alguno de los otros tres enlaces, de lo contrario el carbono violaría la regla del octeto. Si se rompe el enlace con el grupo OH, entonces se regresa al principio. Esto, de hecho, ocurre porque la primera reacción es reversible. La única otra opción es que se rompa el enlace con el hidrógeno, el cual se lleva el par de electrones en búsqueda de un centro positivo donde atacar. Dicho centro lo proporciona el carbono carbonílico de una segunda molécula de aldehído.
Durante esta etapa, el carbono carbonílico del aldehído original pasa de tener dos enlaces con oxígeno a tener tres. Además, pierde un enlace con hidrógeno. Esto significa que este carbono se oxida durante esta etapa. Por otro lado, el segundo carbono carbonílico que tenía un enlace doble con el oxígeno ahora pasa a tener solo uno, mientras que también termina con un hidrógeno adicional. Por esta razón, este carbono se reduce durante la segunda etapa de la reacción.
Paso 3: Protonación del alcóxido

Al final del segundo paso de la reacción se obtiene una molécula de ácido carboxílico y un ion alcóxido. Sin embargo, en vista de que los ácidos carboxílicos son mucho más ácidos que los alcoholes, el ion alcóxido rápidamente le quita el protón al ácido carboxílico para dar ion carboxilato y el alcohol, los cuales son los productos finales de la reacción.
Mecanismo de la reacción de Cannizzaro a alta concentración de base
En este caso, el primer paso de la reacción es el mismo que en el caso anterior, i.e. el ataque nucleofílico de la base al carbonilo del aldehído. Sin embargo, hay una etapa adicional antes de la migración del grupo hidruro.
Paso 1: Ataque nucleofílico de la base al carbono carbonílico
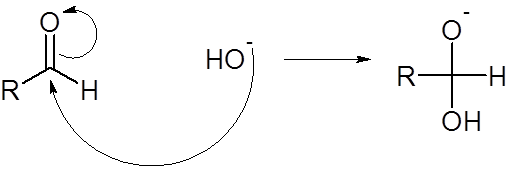
Paso 2: Desprotonación del grupo hidroxilo

Cuando la concentración de la base es lo suficientemente alta, un segundo ion hidróxido de la base ataca al hidroxilo recién formado en el paso 1. Esto forma el dianión RCHO2-2. El dianión RCHO2 pierde el grupo hidruro más fácilmente que la especie del mecanismo anterior.
Paso 3: Migración de grupo hidruro

Esta etapa es equivalente a desprotonación del grupo hidroxilo, con la diferencia de que se, en lugar del ácido carboxilítico neutro, se forma el carboxilato directamente. Como en el caso anterior, también se forma un alcóxido.
Paso 4: Protonación del alcóxido

Para dar el alcohol final, se debe protonar el ion alcóxido formado en la etapa anterior. En este caso ya no está disponible el hidrógeno del ácido carboxílico, así que el alcóxido le quita un protón una molécula de agua que actúa como solvente, regenerando la segunda molécula de hidróxido.
Cinética de reacción
En vista de que el mecanismo varía con la concentración de la base, la cinética de la reacción o su ley de velocidad también varía. Cuando la concentración de la base es baja, la reacción sigue una cinética de tercer orden (segundo respecto al aldehído y primero respecto al hidróxido), como muestra la siguiente ecuación:

En cambio, cuando la concentración de la base es alta, además de actuar como reactivo, el hidróxido también actúa como catalizador. Por esta razón, la reacción sigue una cinética de segundo orden con respecto a los iones hidróxido, y de cuarto orden global:
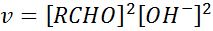
Aplicaciones de la reacción de Cannizzaro
Lo que hace que la reacción de Cannizzaro sea prometedora es que se da a temperatura ambiente y a presión atmosférica (es decir, a presiones moderadamente bajas del orden de 1 atmósfera), mientras que muchas otras reacciones sintéticas que dan productos similares requieren temperaturas o presiones altas. Además, generalmente se puede llevar a cabo utilizando agua como solvente. Ambas características hacen de esta reacción una vía más económica de reducir aldehídos a alcoholes a nivel industrial.
Algunas de las aplicaciones más importantes involucran la síntesis de diferentes glicoles y polioles que son de gran importancia en la industria. Algunos son el neopentilglicol (2,2-dimetilpropano-1,3-diol), el 2,2-bis (hidroximetil) propano-1,3-diol, y el 2-etil-2-hidroximetil. Estos compuestos se utilizan como base para la preparación de barnices, plastificantes y emulsificantes, así como sustitutos de la glicerina.
Ejemplos de la reacción de Cannizzaro
Reacción del benzaldehído:

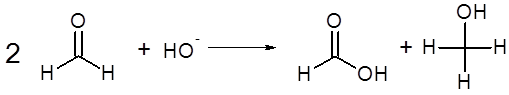
Reacción del formaldehído:
Reacción del 2,2-dimetilpropanal:
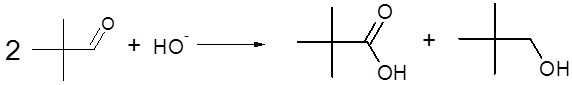
Referencias
- Carey, F., & Giuliano, R. (2014). Química orgánica (9.a ed.). Madrid, España: McGraw-Hill Interamericana de España S.L.
- Smith, M. B., & March, J. (2001). March’s Advanced Organic Chemistry: Reactions, Mechanisms, and Structure, 5th Edition (5th ed.). Hoboken, New Jersey: Wiley-Interscience.
- Reyez, D. (2015). Reacción de Cannizzaro. Recuperado de https://www.slideshare.net/DanielaReyes20/reaccin-de-cannizzaro
- Cannizzaro Reaction: Industrial Importance (s.f.). Recuperado de http://www.chemgapedia.de/vsengine/vlu/vsc/en/ch/2/vlu/oxidation_reduktion/red_cannizzaro.vlu/Page/vsc/en/ch/2/oc/reaktionen/formale_systematik/oxidation_reduktion/reduktion/ersatz_o_n_durch_h/carbonsaeuren_und_derivate/cannizzaro/anwendung2.vscml.html



