Tabla de Contenidos
El ácido acético glacial es un nombre común con el que se conoce al ácido acético puro o anhidro. Consiste en ácido acético con una pureza mínima del 99,8 % que contiene una proporción muy baja de agua o de otras impurezas. El término glacial se utiliza para distinguirlo del ácido acético ordinario, con el cual generalmente nos referimos a disoluciones acuosas de este compuesto.
El ácido acético es un compuesto orgánico perteneciente al grupo de los ácidos carboxílicos. Esta familia de ácidos orgánicos son todos ácidos débiles y sus propiedades dependen fuertemente de su estructura.
La palabra glacial proviene del hecho que tiene un punto de fusión de 16,6 °C, por lo que se solidifica o congela a temperaturas relativamente altas formando cristales similares a los del hielo.
Estructura y nomenclatura del ácido acético
Ácido acético es el nombre común del ácido carboxílico de dos átomos de carbono. En este sentido, su nombre sistemático según las reglas de nomenclatura de la Unión Internacional de Química Pura y Aplicada (IUPAC, por sus siglas en inglés) es ácido etanoico.
El nombre común “acético” proviene del hecho que el ácido etanoico es, después del agua, el componente principal del vinagre, cuyo nombre en latín es acetum. A pesar de ser un nombre común, está tan difundido y es de uso tan cotidiano en toda la ciencia que la IUPAC acepta su uso como nombre oficial del compuesto.
La fórmula molecular del ácido acético es CH3COOH. Su estructura se muestra en la siguiente figura:
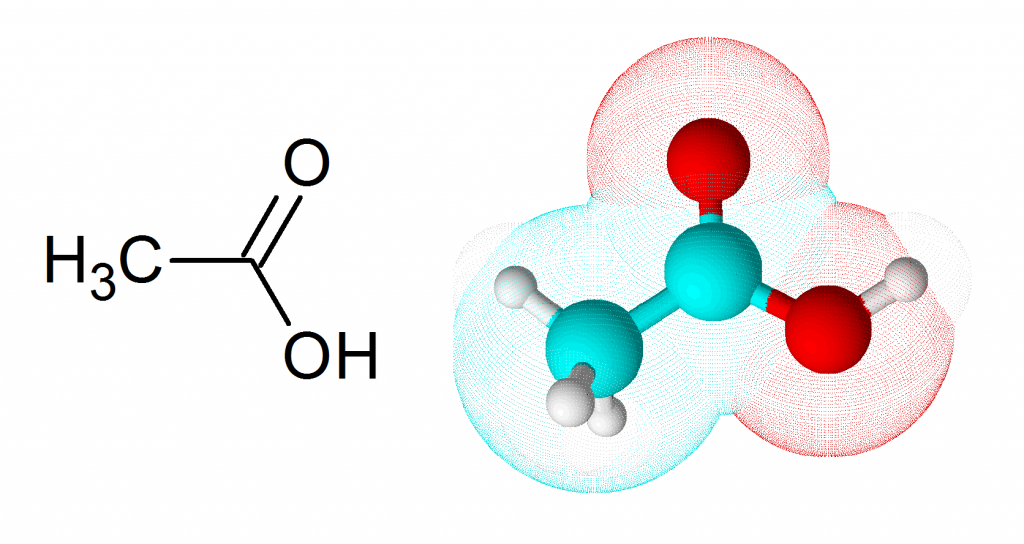
Características del ácido acético glacial
- Es un líquido transparente e incoloro a temperatura ambiente pero que se congela fácilmente en climas fríos.
- Presenta un olor y sabor a vinagre muy intenso y penetrante, ya que corresponde al componente activo principal de este aderezo que es ubicuo en todo el mundo.
- Su punto de fusión es 16,6 °C. Por debajo de esta temperatura es un sólido cristalino de color blanco.
- Su punto de ebullición es 118 °C, ligeramente mayor que el del agua.
- Es un líquido miscible con el agua, lo que significa que se pueden preparar mezclas agua-ácido acético glacial en cualquier proporción.
- Es un ácido débil con una constante de ionización ácida de Ka = 1,75.10-5.
¿Cómo se obtiene el ácido acético glacial?
Existen dos clases de procesos que se utilizan para producir ácido acético. La primera clase es la fermentación de azúcares utilizando distintos tipos de microorganismos como levaduras y bacterias; la segunda consiste en los distintos tipos de síntesis química industrial.
Fermentación
La fermentación es evidentemente la forma más antigua de obtener ácido acético, ya que el vinagre, que no es más que una disolución acuosa de este compuesto, se produce de esta manera desde hace cientos de años. Sin embargo, este proceso no produce ácido acético glacial sino ácido acético ordinario que, a lo sumo, tiene una concentración de alrededor del 10 % en masa. Sin embargo, este tipo de disoluciones se puede destilar para obtener disoluciones más concentradas, aunque difícilmente se logra obtener la pureza requerida para considerarse ácido acético glacial.
Síntesis industrial
Actualmente, la mayor parte del ácido acético del mundo se produce industrialmente por medio de reacciones químicas. Existen varias reacciones distintas que dan ácido acético como producto principal y que se han aprovechado para producir este ácido orgánico. Algunos ejemplos son la oxidación de acetaldehído, la oxidación de hidrocarburos en fase líquida y la carbonilación del metanol.
Además de ser procesos mucho más rápidos que la biosíntesis por fermentación, uno de los beneficios de la síntesis industrial es que permite la síntesis del ácido acético en ausencia de agua. Consecuentemente, el proceso de purificación del producto terminado resulta mucho más sencillo y es más fácil obtener el ácido acético glacial.
Formación de estalactitas de ácido acético glacial
Una tercera forma ingeniosa de obtener ácido acético glacial parte de una disolución acuosa de ácido acético, la cual se enfría por debajo de 16,6°C (su punto de fusión) y se deja evaporar lentamente hasta que se comiencen a formar cristales del ácido. De allí en adelante, si dejamos gotear una solución fría y concentrada de ácido acético desde estos cristales, una parte del ácido acético cristalizará mientras que el resto goteará con el agua.
Como el proceso de cristalización, si se hace lentamente, incorpora solo moléculas de ácido acético puro, esta es una forma de purificación de ácido acético que es muy efectiva. Luego basta con separar las estalactitas de ácido acético puro en estado sólido, secarlas bien y luego fundirlas nuevamente para obtener así ácido acético glacial.
Diferencias entre el ácido acético glacial y el ordinario
Diferencias en composición
Como se puede ver, tanto el ácido acético glacial como el ácido acético ordinario se refieren al ácido etanoico o al ácido carboxílico de dos átomos de carbono. Sin embargo, la diferencia radica en la pureza y en presencia o no de agua. El ácido acético glacial corresponde a dicho compuesto purificado y deshidratado, desprovisto de agua y prácticamente de cualquier otra sustancia química. Es decir, que el término glacial se añade con la finalidad de indicar que se trata de un compuesto químico puro.
En cambio, cuando hablamos de ácido acético ordinario (o simplemente ácido acético, a secas), nos podemos referir tanto al compuesto químico en sí, o a cualquier mezcla o disolución acuosa de ácido acético. Es decir, no especificamos si se trata de una sustancia pura o de una mezcla.
Diferencias en aplicación
La mayoría de los procesos de síntesis orgánica requieren la ausencia de agua por diferentes razones. En muchos casos, el agua puede reaccionar con algunos de los reactivos, con el catalizador, o incluso con el producto de la reacción, reduciendo considerablemente el rendimiento. Adicionalmente, muchas reacciones orgánicas se llevan a cabo en solventes apolares que son inmiscibles (o sea, que no pueden mezclarse) con el agua. Esto hace que el uso de disoluciones acuosas de ácido acético no sea conveniente porque se produce la separación de dos fases (la fase acuosa y la fase orgánica), en la que la mayor parte del ácido acético queda repartida en la fase acuosa; por lo tanto, no está disponible para reaccionar en el solvente orgánico. En estos casos, no cualquier presentación de ácido acético sirve como reactivo, por lo que es indispensable utilizar exclusivamente ácido acético glacial.
Diferencias en peligrosidad
A pesar de que el ácido acético es un ácido débil y sus disoluciones son seguras incluso para consumir, ese no es el caso con el ácido acético glacial. Por estar prácticamente puro, no conseguiremos ácido acético más concentrado que el glacial, razón por la cual puede llegar a ser irritante para la piel.
Referencias
Ácido acético glacial. (2017, 11 agosto). Quimipedia. https://www.vadequimica.com/quimipedia/a/acido-acetico-glacial/
Chang, R. (2021). Quimica (11.a ed.). MCGRAW HILL EDDUCATION.
Ministerio del Trabajo, Migraciones y Seguridad Social. (2018). DOCUMENTACIÓN TOXICOLÓGICA PARA LA VL ACTUALIZACIÓN DEL LÍMITE DE EXPOSICIÓN PROFESIONAL DEL ÁCIDO ACÉTICO. Documentación Límites Exposición Profesional. https://www.insst.es/documents/94886/431980/DLEP+119+%C3%81cido+ac%C3%A9tico++A%C3%B1o+2018.pdf/1d5b5a9a-4438-4105-8b77-3e68196f2701?version=1.0&t=1551310408920
Sánchez Levoso, A. (2016, junio). Modelado del Proceso de Extracción de Ácido Acético con Recuperación de Disolvente Orgánico. Universidad Politécnica de Madrid. https://oa.upm.es/42845/1/TFG_ANA_SANCHEZ_LEVOSO.pdf
Wolfram. (s. f.). SeparationofAceticAcidfromWaterUsingEthylAcetateEntrainer. Wolfram Notebook. https://www.wolframcloud.com/objects/demonstrations/SeparationOfAceticAcidFromWaterUsingEthylAcetateEntrainer-source.nb



