Tabla de Contenidos
Un ion complejo es una especie química formada por un átomo metálico central, muchas veces con estado de oxidación positivo, el cual está enlazado por un grupo de moléculas neutras o iones negativos, por medio de enlaces covalentes dativos o coordinados. Al átomo metálico central se le denomina centro de coordinación (por lo que se dice que estos son un tipo de complejo de coordinación), mientras que a las moléculas o iones donadores de los pares de electrones de los enlaces coordinados se les denomina ligandos.
Dependiendo de la carga eléctrica del centro metálico y la de los ligandos, los iones complejos pueden ser positivos (cationes complejos) o negativos (aniones complejos).
Los iones complejos son mucho más comunes de lo que nos podemos imaginar y forman parte de las sales complejas. De hecho, su presencia en una sal es justamente lo que la clasifica como sal compleja.
Características de los iones complejos
Algunos rasgos característicos de estas especies químicas son:
- El átomo metálico central casi siempre es un metal de transición (bloque d) o un metal de transición interna (bloque f, formado por los lantánidos y actínidos). En algunos casos pueden ser metales del bloque p.
- Pueden existir en solución o en forma de sales complejas en estado sólido.
- Debido a que el átomo central recibe un par de electrones en un enlace covalente dativo, se comporta como un ácido de Lewis.
- Los ligandos pueden ser moléculas neutras como el agua (H2O) o el amoníaco (NH3) o pueden ser aniones mono- o poliatómicos como el ion cloruro (Cl–) o el ion cianuro (CN–).
- Los ligandos siempre deben tener átomos con pares de electrones libres sin compartir como sucede con muchos compuestos que contienen oxígeno, nitrógeno, azufre y fósforo.
- Los ligandos, al ser donadores de un par de electrones, son bases de Lewis.
- Un mismo ligando puede aportar más de un par de electrones a través de más de un átomo con pares de electrones libres en cuyo caso se suele denominar agente quelante, tal como en el caso del ion etilendiamintetraacetato o EDTA4-.
Tipos de iones complejos
Dependiendo de las características particulares del centro metálico y de los ligandos que le rodean, se pueden distinguir algunos tipos diferentes de iones complejos:
Cationes complejos
Son los iones complejos con carga positiva.
Aniones complejos
Son los iones complejos con cargas negativa.
Iones complejos mononucleares con ligandos monodentados
Son los más comunes y se refiere a aquellos que solo contienen un centro metálico el cual está rodeado de ligandos que solo aportan un par de electrones cada uno. A este tipo de ligandos se le denomina ligando monodentado.
Quelatos: Iones complejos mononucleares con ligandos polidentados
Son aquellos en los que un único centro metálico está enlazado a un solo ligando, pero a través de múltiples enlaces coordinados. A los ligandos con varios átomos donantes se les denomina ligandos polidentados o agentes quelantes, y a los complejos que forman con diferentes metales se les denomina quelatos. Si el complejo tiene carga eléctrica será también un ion complejo.
Iones complejos polinucleares
Existen ejemplos de iones complejos en los que varios centros metálicos están unidos entre sí, bien sea por medio de un enlace metálico (como en el caso del ion [Re2Cl4]2-) o por medio de un ligando bidentado que actúa como puente entre los dos centros metálicos (como en el caso del ion [(NH3)5] Co – NH2 – Co(NH3)5]5+). Este tipo de complejo se denominan complejos polinucleares, ya que poseen más de un centro de coordinación.
Ejemplos de iones complejos
Como se mencionó al principio, los iones complejos pueden ser tanto positivos como negativos, el centro metálico puede ser positivo o neutro y los ligandos enlazados al mismo pueden ser tanto moléculas neutras como iones negativos. Además, pueden contener uno o más centros de coordinación. A continuación, se presentan algunos ejemplos en los que se resaltan estas características.
Ejemplo 1: El catión [(NH3)5Ru(C4H4N2)Ru(NH3)5]5+
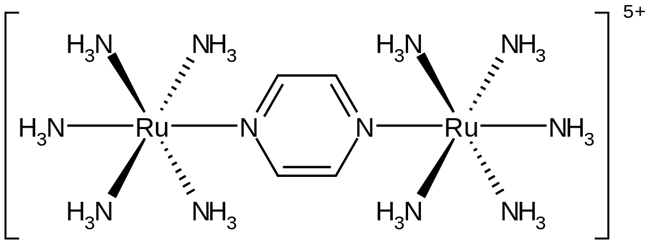
Este es un ejemplo de un catión complejo polinuclear con ligandos neutros y centros metálicos positivos.
Ejemplo 2: El anión hexacianoferrato (II) o [Fe(CN)6]4+
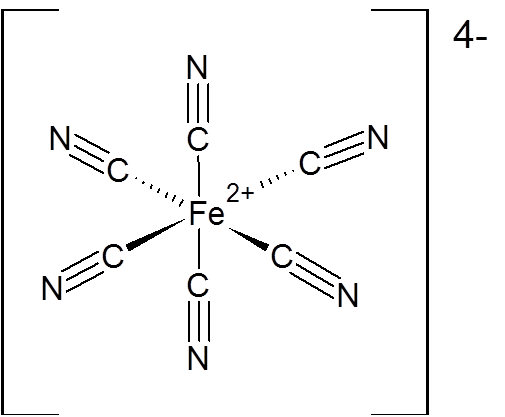
Este es un ejemplo de un ion complejo mononuclear con un átomo central positivo, pero carga neta negativa.
Ejemplo 3: [Co(SO4)(NH3)5]+
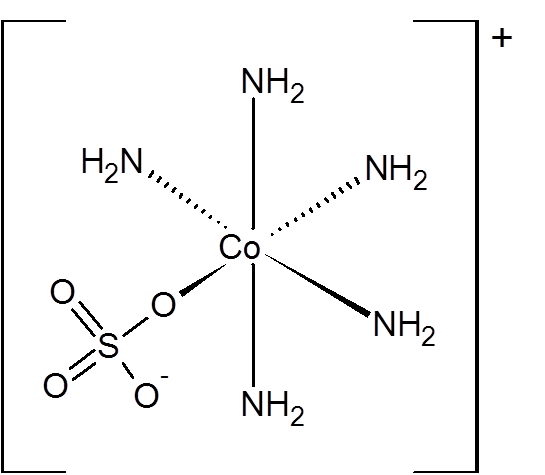
El [Co(SO4)(NH3)5]+ es un catión complejo mononuclear que posee un cobalto (III) en su centro rodeado de 5 ligandos amino neutros y un ligando sulfato negativo.
Ejemplo 4: [Au6C(PPh3)6]2+
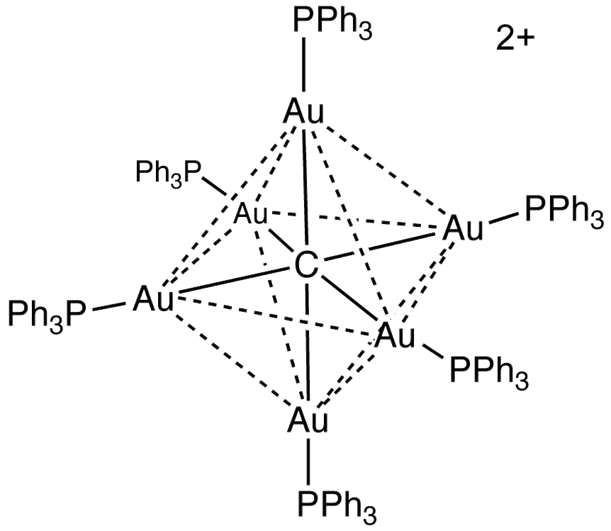
Este es otro ejemplo de un ion complejo polinuclear con carga positiva en el que un anión carburo hace las veces de puente entre todos los centros metálicos conformados por 6 cationes oro (I).
Referencias
Coordination compound – Ligands and chelates. (2021). Recuperado 29 de mayo de 2021, de https://www.britannica.com/science/coordination-compound/Ligands-and-chelates
Cotton, Frank Albert; Wilkinson, Geoffrey, Murillo, Carlos A.; Bochmann, Manfred. (1999). Química inorgánica avanzada. 6ta ed. Wiley
Lawrance, Geoffrey A. (2010). Introducción a la Química de la Coordinación. Wiley. https://onlinelibrary.wiley.com/doi/book/10.1002/9780470687123



