Tabla de Contenidos
Los átomos están formados por un núcleo rodeado de electrones que giran a gran velocidad a su alrededor. El núcleo está formado por protones y neutrones y el número de protones es la parte del átomo que le da su identidad. Esta es la razón por la cual a este número se le llama número atómico.
La carga de cada protón es de igual magnitud pero de signo contrario a la carga del electrón. Por esta razón, se entiende que en el núcleo de un átomo neutro debe haber el mismo número de electrones que de protones. En este sentido, el número de electrones en un átomo neutro viene determinado por el número atómico (Z).
Esto resulta muy sencillo de entender, pero ¿qué sucede en el caso de los iones? ¿Cómo se determina el número de electrones y de protones en un catión o en un anión? Para entenderlo debemos comprender primero qué son los iones y cómo se forman.
¿Qué es un ion?
Un ion es cualquier especie química que posea una carga eléctrica neta. Esto implica que debe haber un desbalance entre el número de cargas positivas en el núcleo y el número de cargas negativas en la nube electrónica que lo rodea. Dicho de otra forma, un ion es una especie química en la que el número de protones y electrones no es igual.
Los iones se forman en las reacciones químicas por medio de pérdida o ganancia de electrones, independientemente de si el ion es positivo o negativo. Esto se debe a que las reacciones químicas nunca involucran al núcleo, sino solamente a los electrones de valencia, que son los electrones más externos de un átomo.
La pérdida o ganancia de electrones da origen a dos tipos de iones según su carga: cationes y aniones.
Cationes
Son aquellos iones que poseen una carga neta positiva. Estos iones se forman cuando un átomo neutro pierde uno o más electrones. El término catión proviene del hecho de que, durante la electrólisis de una disolución o de una sal fundida, estos iones son los que se dirigen hacia el cátodo, o electrodo en el que ocurre la reacción de reducción.
¿Cómo calcular el número de protones y electrones en un catión?
La carga positiva de los cationes no se debe a que el núcleo haya ganado protones con carga positiva, sino a que el átomo perdió electrones con carga negativa, por lo que queda un exceso de cargas positivas. Por esta razón, el valor de la carga positiva representa el número de electrones que el átomo neutro perdió para convertirse en el catión.
En vista de esto, el número de electrones de un catión no es más que el número de electrones que tenía originalmente el átomo neutro, menos el número de cargas positivas del catión. Por otro lado, como el núcleo del átomo no se ve afectado al formar el catión, el número de protones tanto en el átomo neutro como en el catión es el mismo, y es igual al número atómico del elemento en cuestión.
Si llamamos p al número de protones, ne– al número de electrones, y q a la carga del catión, podemos decir, entonces, que:
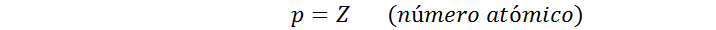
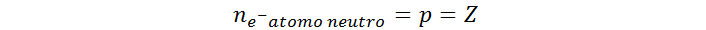
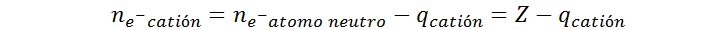
En resumen, el número de protones en un catión es igual al número atómico del elemento, mientras que el número de electrones viene dado por la resta del número atómico y la carga del ion:

Aniones
Los aniones son lo contrario de los cationes. Son iones que tienen una carga neta negativa y que se dirigen hacia el ánodo en las celdas de electrólisis, hecho del que obtienen su nombre. Los aniones se forman cuando un átomo neutro gana electrones, lo que crea un exceso de cargas negativas que no es balanceada por las cargas positivas del núcleo.
¿Cómo calcular el número de protones y electrones en un catión?
Siguiendo la misma lógica que antes, el número de protones en el núcleo de un anión monoatómico es el mismo que en el átomo neutro, por lo que se sigue cumpliendo que p = Z. En cambio, el número de electrones es, en este caso, la suma del número de electrones del átomo neutro, más el número de cargas negativas del anión. Esto se puede escribir como:
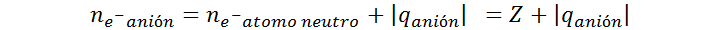
En este caso, se debe tomar el valor absoluto de q para que el valor se sume, ya que los aniones tienen más electrones que los átomos neutros. Por lo tanto, para calcular el número de protones y electrones en un anión se utilizan las siguientes fórmulas:
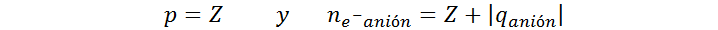
Forma general de calcular el número de protones y electrones de un ion
Como podemos ver de las dos expresiones anteriores, para determinar el número de electrones de un ion basta con sumar o restar la carga dependiendo de si se trata de un anión o un catión. Sin embargo, esto es equivalente a siempre restar la carga eléctrica del ion, en tanto incluyamos el signo de la carga al sustituir el valor. De esta manera, estaremos restando si se trata de un catión (porque la carga es positiva y al multiplicar por el menos de la fórmula el resultado es negativo) y sumando si se trata de un anión (porque el producto del negativo de la fórmula con el de la carga da como resultado un signo positivo).
Es decir que, para cualquier ion, sea positivo o negativo, el número de protones y electrones vienen dados por:
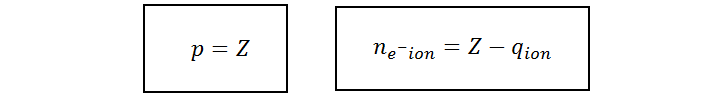
Cálculo del número total de electrones de valencia en iones poliatómicos
Además de distinguirse por su carga, los iones también pueden diferir en el número de átomos que los conforman. Los apartados anteriores corresponden a cationes y aniones formados por un solo átomo. Es decir, la ecuación anterior aplica únicamente a iones monoatómicos (aunque se puede adaptar para otros tipos de iones).
Sin embargo, existe también una gran variedad de cationes y aniones moleculares, compuestos por dos o más átomos enlazados entre sí por medio de enlaces covalentes. En estos casos, resulta importante determinar el número de electrones en este tipo de iones ya que esta información permite construir las estructuras de Lewis de dichos iones, dando así información sobre los tipos de enlaces que se forman y la geometría molecular en torno al átomo central o átomos centrales, si hay más de uno.
No obstante, en estos casos no es tan importante conocer el número total de electrones en todos los átomos, sino más bien el número total de electrones de valencia, sin incluir a ninguno de los electrones internos de los átomos que conforman al ion.
En este caso, la fórmula del número de electrones se modifica de la siguiente manera:
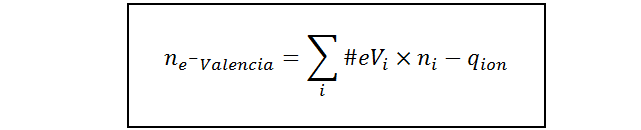
Donde ne-Valencia es el número total de electrones de valencia del ion, #eVi representa el número de electrones de valencia del elemento i, ni es el número de átomos del elemento i presentes en el ion y qion es, nuevamente, la carga del ion con su respectivo signo. El número de electrones de valencia de un elemento se puede determinar bien sea por medio de la configuración electrónica, u observando el grupo en el que se encuentra en la tabla periódica (principalmente en el caso de los elementos representativos).
Ejemplos del cálculo de protones y electrones de iones monoatómicos
Ejemplo #1: Protones y electrones del catión férrico
El catión férrico corresponde al ion Fe3+, un ion monoatómico con un núcleo de hierro. De la tabla periódica obtenemos que el número atómico del hierro es 26 (Z = 26) y, como podemos ver, el ion posee tres cargas positivas (q = +3). Por lo tanto, el número de protones y electrones del catión férrico es:
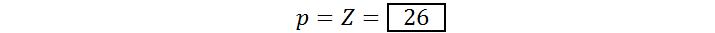
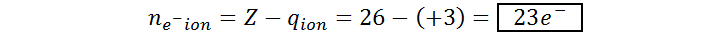
Ejemplo #2: Protones y electrones del anión sulfuro
El anión sulfuro corresponde al ion S2-, un ion monoatómico con un núcleo de azufre y dos cargas eléctricas negativas. El número atómico del azufre es 16 (Z = 16) y, en este caso, q = – 2. Por lo tanto, el número de protones y electrones del anión sulfuro es:
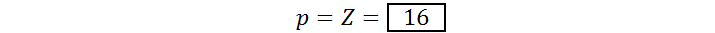
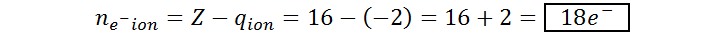
Ejemplos del cálculo de electrones de valencia de iones poliatómicos
Ejemplo #3: Electrones de valencia del catión amonio (NH4+)
El catión amonio está formado por 4 átomos de hidrógeno y uno de nitrógeno y posee una carga positiva de +1. El elemento hidrógeno pertenece al grupo 1A de la tabla periódica por lo que posee 1 electrón de valencia, mientras que el nitrógeno pertenece al grupo 5A, por lo que tiene 5 electrones de valencia. Aplicando la fórmula para el número de electrones de valencia de iones polielectrónicos, tenemos:
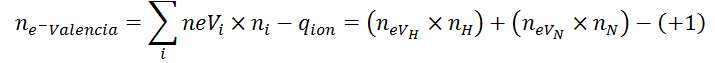
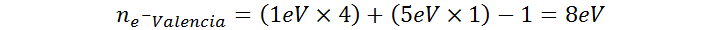
Por lo tanto, el ion amonio posee un total de 8 electrones de valencia repartidos entre sus cinco átomos.
Ejemplo #4: Electrones de valencia del anión nitrato (NO3–)
El anión nitrato está formado por 3 átomos de oxígeno y uno de nitrógeno y posee una carga negativa de – 1. El elemento oxígeno pertenece al grupo 6A de la tabla periódica por lo que posee 6 electrones de valencia, mientras posee 5 electrones de valencia, como vimos en el ejemplo anterior. Aplicando nuevamente la fórmula, tenemos:
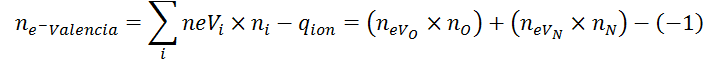
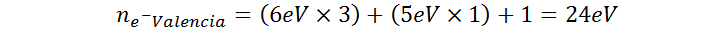
Por lo tanto, el ion nitrato posee un total de 24 electrones de valencia repartidos entre sus cuatro átomos.
Referencias
Calcular el numero de electrones y el numero de neutrones en iones. (2019, 4 septiembre). YouTube. https://www.youtube.com/watch?v=nM7npEf27Do
Miralles, A. (2009, 4 agosto). Protones, neutrones y electrones. Isótopos. Iones 02 – El Sapo Sabio. El Sapo Sabio. https://www.elsaposabio.com/quimica/?p=780
REPRESENTACIÓN DE IONES. (s. f.). 3° Eso. http://newton.cnice.mec.es/materiales_didacticos/el_atomo/iones.htm?4&1
wikiHow. (2019, 5 enero). Cómo encontrar el número de protones, neutrones y electrones. https://es.wikihow.com/encontrar-el-n%C3%BAmero-de-protones,-neutrones-y-electrones



