Tabla de Contenidos
El calor específico (Ce) es la cantidad de calor que se debe administrar a una unidad de masa de un material para aumentar su temperatura en una unidad. Se trata de una propiedad térmica intensiva de la materia, es decir, que no depende de la extensión del material o de su cantidad, sino únicamente de su composición. En este sentido es una propiedad característica que resulta de gran importancia para determinar las posibles aplicaciones de cada material, y que ayuda a determinar parte del comportamiento térmico de las sustancias cuando entran en contacto con cuerpos o medios que se encuentran a temperaturas diferentes.
Desde cierto punto de vista podríamos decir que el calor específico corresponde a la versión intensiva de la capacidad calórica (C), definiéndola como la cantidad de calor que se debe suministrar a un sistema para aumentar su temperatura en una unidad. También se puede entender como la constante de proporcionalidad entre la capacidad calórica de un sistema (un cuerpo, una sustancia, etcétera) y su masa.
El valor del calor específico de una sustancia depende de si el calentamiento (o enfriamiento) se lleva a cabo a presión constante o a volumen constante. Esto da origen a dos calores específicos para cada sustancia, a saber, el calor específico a presión constante (CP) y el calor específico a volumen constante (CV). Sin embargo, la diferencia solo se puede apreciar en gases, por lo que para líquidos y sólidos solemos hablar simplemente de calor específico a secas.
Fórmula de calor específico
Sabemos por experiencia que la capacidad calórica de un cuerpo es proporcional a su masa, es decir, que
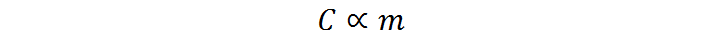
Como mencionamos en la sección anterior, el calor específico representa la constante de proporcionalidad entre estas dos variables, por lo que la relación de proporcionalidad anterior se puede escribir en forma de la siguiente ecuación:

Podemos resolver esta ecuación para obtener una expresión para el calor específico:
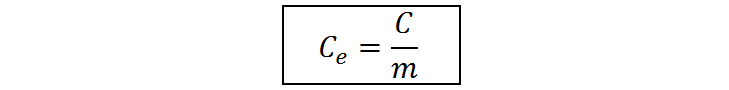
Por otro lado, sabemos que la capacidad calórica es la constante de proporcionalidad entre el calor (q) que se requiere para aumentar la temperatura de un sistema en una cantidad ΔT y dicho aumento de temperatura. En otras palabras, sabemos que q = C * ΔT. Combinando esta ecuación con la de capacidad calórica mostrada anteriormente, obtenemos:
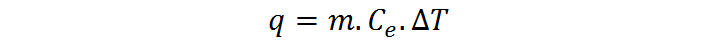
Resolviendo esta ecuación para hallar el calor específico, obtenemos una segunda ecuación para el mismo:
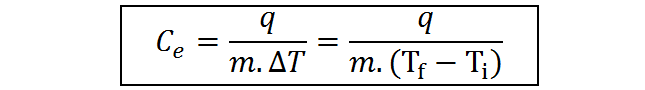
Unidades del calor específico
La última ecuación obtenida para el calor específico demuestra que las unidades de esta variable son [q][m]-1[ΔT]-1, es decir, unidades de calor sobre unidades de masa y temperatura. Dependiendo del sistema de unidades en el que se esté trabajando, estas unidades pueden ser:
| Sistema de unidades | Unidades de calor específico |
| Sistema Internacional | J.kg-1.K-1 que es equivalente a m2⋅K−1⋅s−2 |
| Sistema Imperial | BTU⋅lb−1⋅°F−1 |
| Calorías | cal.g-1.°C-1 que es equivalente a Cal.kg-1.°C-1 |
| Otras unidades | kJ.kg-1.K-1 |
NOTA: Al utilizar estas unidades es importante hacer la distinción entre cal y Cal. La primera es la caloría normal (a veces llamada caloría pequeña o caloría-gramo), correspondiente a la cantidad de calor requerida para aumentar en 1°C la temperatura de 1g de agua, mientras que Cal (con mayúscula) es una unidad equivalente a 1.000 cal, o, lo que es lo mismo, 1 kcal. Esta última unidad de calor es de uso cotidiano en ciencias de la salud, en especial en el área de nutrición. En dicho contexto, es la unidad por excelencia utilizada para representar la cantidad de energía presente en los alimentos (cuando hablamos de calorías en el contexto de los alimentos, casi siempre nos referimos a Cal y no a cal).
Ejemplos de problemas de cálculo de calor específico
A continuación se presentan dos problemas resueltos en los que se ejemplifica tanto el proceso del cálculo del calor específico para una sustancia pura como para una mezcla de sustancias puras en la que conocemos los calores específicos.
Problema 1: Cálculo de calor específico de una sustancia pura
Enunciado: Se desea determinar la composición de una muestra de un metal plateado desconocido. Se sospecha que puede tratarse de plata, aluminio o platino. Para determinar qué es, se mide la cantidad de calor necesaria para calentar una muestra de 10,0 g del metal desde una temperatura de 25,0°C hasta el punto de ebullición normal del agua, es decir, 100,0°C, obteniéndose un valor de 41,92 cal. Sabiendo que los calores específicos de la plata, el aluminio y el platino son 0,234 kJ.kg-1.K-1, 0,897 kJ.kg-1.K-1 y 0.129 kJ.kg-1.K-1, respectivamente, determine de qué metal está hecha la muestra.
Solución
Lo que el problema pide es que se identifique el material del que está fabricado el objeto. Como el calor específico es una propiedad intensiva, es característica de cada material, por lo que, para identificarlo, basta con determinar su calor específico y luego compararlo con los valores conocidos de los metales sospechosos.
La determinación del calor específico en este caso se lleva a cabo por medio de tres simples pasos:
Paso #1: Extraer todos los datos del enunciado y llevar a cabo las transformaciones de unidades relevantes
Como en todo problema, lo primero que necesitamos es organizar los datos para tenerlos a la mano al momento de necesitarlos. Además, llevar a cabo las transformaciones de unidades desde el principio evitará que se nos olvide más adelante y además hará que los cálculos sean más sencillos en los siguientes pasos.
En este caso, el enunciado proporciona la masa de la muestra, las temperaturas inicial y final luego de un proceso de calentamiento y la cantidad de calor requerida para calentar la muestra. También proporciona los calores específicos de los tres metales candidatos. En términos de unidades, podemos notar que los calores específicos están en kJ.kg-1.K.1, pero la masa, las temperaturas y el calor están en g, °C y cal, respectivamente. Debemos entonces transformar unidades para que todo esté en el mismo sistema. Es más sencillo transformar por separado la masa, temperatura y calor que transformar tres veces las unidades compuestas del calor específico, por lo que ese será el camino que seguiremos:
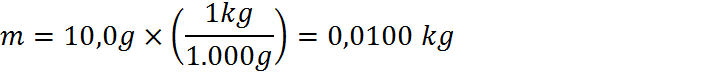
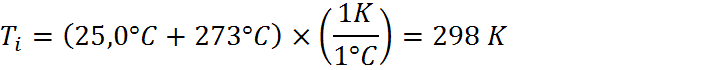
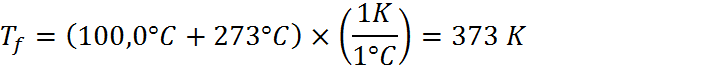
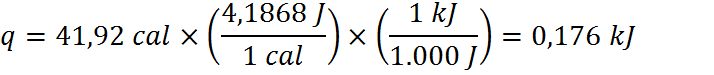
Paso #2: Utilizar la ecuación para calcular el calor específico
Ahora que tenemos todos los datos que necesitamos, solo hace falta emplear la ecuación adecuada para calcular el calor específico. Dados los datos con los que contamos, utilizaremos la segunda ecuación para Ce presentada anteriormente.
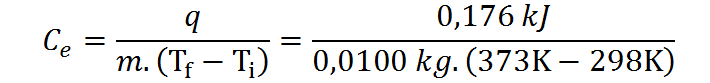
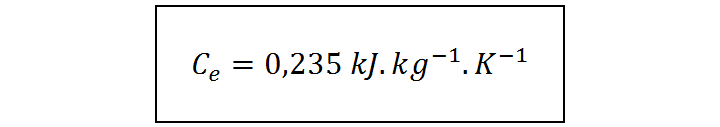
Paso #3: Comparar el calor específico de la muestra con los calores específicos conocidos para identificar el material
Al comparar el calor específico obtenido para nuestra muestra con el de los tres metales candidatos, observamos que el que más se le parece es la plata. Por esta razón, si los únicos candidatos son los metales plata, aluminio y platino, concluimos que la muestra está compuesta de plata.
Problema 2: Cálculo de calor específico de una mezcla de sustancias puras
Enunciado: ¿Cuál será el calor específico promedio de una aleación que contiene 85 % de cobre, 5 % de zinc, 5 % de estaño y 5 % de plomo? Los calores específicos de cada metal son, Ce, Cu = 385 J.kg-1.K-1; Ce, Zn =381 J.kg-1.K-1; Ce, Sn = 230 J.kg-1.K-1; Ce, Pb = 130 J.kg-1.K-1.
Solución
Este es un problema un poco diferente que requiere un poco más de creatividad. Cuando tenemos mezclas de materiales distintos, las propiedades térmicas y otras propiedades dependerán de la composición particular y, en general, serán distintas a las propiedades de los componentes puros.
Como el calor específico es una propiedad intensiva, no es una cantidad aditiva, lo que significa que no podemos sumar los calores específicos para obtener un calor específico total en el caso de una mezcla. Sin embargo, lo que sí es aditivo es la capacidad calórica total, ya que esta es una propiedad extensiva.
Por esta razón podemos decir que, en el caso de la aleación presentada, la capacidad calórica total de la aleación será la suma de las capacidades calóricas de la porción de cobre, de zinc, de estaño y de plomo, es decir:
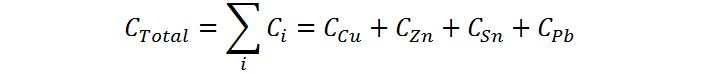
Sin embargo, en cada caso la capacidad calórica corresponde al producto entre la masa y el calor específico, por lo que esta ecuación se puede reescribir como:
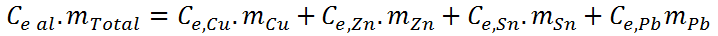
Donde Ce al representa el calor específico promedio de la aleación (nótese que no es correcto decir calor específico total), es decir, la incógnita que deseamos hallar. Como esta propiedad es intensiva, su cálculo no dependerá de la cantidad de muestra que tengamos. En vista de esto, podemos asumir que tenemos 100 g de aleación, en cuyo caso las masas de cada uno de los componentes serán iguales a sus respectivos porcentajes. Al asumir esto, obtenemos todos los datos necesarios para el cálculo del calor específico promedio.
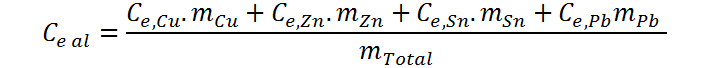
Ahora sustituimos los valores conocidos y llevamos a cabo el cálculo. Por simplicidad, se omitirán las unidades al sustituir los valores. Esto solo podemos hacerlo gracias a que todos los calores específicos están en el mismo sistema de unidades, al igual que todas las masas. No es necesario convertir las masas a kilogramos, ya que los gramos del numerador al final se cancelarán con los del denominador.

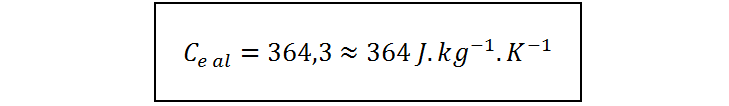
Referencias
Broncesval SL. (2019, 20 diciembre). B5 | Bronce Aleación de Cobre Estaño Zinc. Broncesval. https://www.broncesval.com/bronce/b5-bronce-aleacion-de-cobre-estanio-zinc/
Chang, R. (2002). Fisicoquimica (1.a ed.). MCGRAW HILL EDDUCATION.
Chang, R. (2021). Quimica (11.a ed.). MCGRAW HILL EDDUCATION.
Franco G., A. (2011). DeterminaciÃ3n del calor especÃfico de un sÃ3lido. Física con ordenador. http://www.sc.ehu.es/sbweb/fisica/estadistica/otros/calorimetro/calorimetro.htm
Specific heat of metals. (2020, 29 octubre). Sciencealpha. https://sciencealpha.com/es/specific-heat-of-metals/



