Tabla de Contenidos
Los átomos son las unidades fundamentales que conforman a los distintos elementos químicos que, a su vez, forman parte de la materia. Si bien es cierto que dos átomos del mismo elemento poseen el mismo número de protones y electrones y comparten esencialmente las mismas propiedades químicas, no todos los átomos de un mismo elemento son iguales entre sí. Esto se debe a la existencia de los isótopos, que no son más que átomos del mismo elemento, pero que poseen distinto número de masa.
Pero si en una muestra pura de cualquier elemento hay en realidad una mezcla de átomos con las mismas propiedades, pero con distinta masa, ¿por qué la tabla periódica solo muestra una masa atómica por cada elemento?
La respuesta es que la tabla periódica en realidad no muestra la masa de un átomo de cada elemento, sino que muestra la masa promedio de todos los átomos presentes en una muestra natural de dicho elemento.
Masa atómica frente a masa atómica promedio
Como indica su nombre, la masa atómica corresponde a la masa de un átomo individual. Es decir, es la masa correspondiente a un átomo de un isótopo particular de un elemento químico. Como es de suponer, se trata de una masa extremadamente pequeña; tan pequeña, de hecho, que se expresa en unidades de masa especiales denominadas unidad de masa atómica o uma.
Por su parte, la masa atómica promedio representa, como se dijo anteriormente, el promedio de la masa de todos los átomos presentes en una muestra natural de un elemento. Esta masa se calcula como el promedio de la masa de todos los isótopos naturales de un elemento, ponderados por su abundancia isotópica relativa natural. Es decir:

Donde MAi representa la masa atómica del isótopo natural i, y %Ai representa la abundancia relativa en forma de porcentaje de dicho isótopo. Para la aplicación de esta ecuación, se requieren todas las masas y abundancias de todos los isótopos naturales de un elemento.
No se incluyen en la sumatoria aquellos isótopos que sean inestables y que, por lo tanto, decaigan radiactivamente con el tiempo transformándose en átomos diferentes.
Los siguientes problemas resueltos servirán para ejemplificar el uso de esta fórmula en la determinación de la masa atómica promedio de un elemento.
Ejemplo 1: Determinación de la masa atómica promedio a partir de las abundancias isotópicas
Enunciado
El selenio es un no metal que posee seis isótopos estables, todos con abundancias isotópicas menores que el 50%. El isótopo más abundante es el selenio-80, el cual representa casi la mitad de todos los átomos de selenio en una muestra natural de dicho elemento. La siguiente tabla muestra cada uno de estos isótopos junto con su abundancia relativa y su masa atómica determinada por medio de la técnica de espectrometría de masas. Determine la masa atómica promedio del selenio.
| Isótopo | Masa atómica (uma) | % Abundancia |
| 74Se | 73,922477 | 0,89 |
| 76Se | 75,919214 | 9,37 |
| 77Se | 76,919915 | 7,63 |
| 78Se | 77,917310 | 23,77 |
| 80Se | 79,916522 | 49,61 |
| 82Se | 81,916700 | 8,73 |
Solución
Este tipo de problemas consiste en la aplicación directa de la ecuación anterior. Como se puede ver poseemos todos los datos necesarios para la determinación del peso atómico o masa atómica promedio.


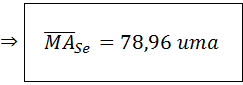
Por lo tanto, la masa atómica promedio del selenio es 78,96 uma.
Ejemplo 2: Determinación de la abundancia de un isótopo a partir de la masa atómica promedio
Enunciado
El hierro es un elemento que se encuentra con muchos meteoritos y la proporción en la que se encuentran sus cuatro isótopos estables proporcionan información importante sobre la procedencia y edad del meteorito. Se analizó una muestra proveniente del meteorito YuB-2021 y se encontró que el hierro presente en el mismo posee una masa atómica promedio de 55,8074 uma, ligeramente inferior a la masa atómica promedio del hierro terrestre, que es 55,845 uma. Se supone que la razón es una mayor proporción del isótopo más liviano hierro-54 (que en el planeta Tierra tiene una abundancia del 5,845%); sin embargo, no se logró determinar con buena exactitud ni la abundancia de este isótopo ni la del menos abundante hierro-58. Utilizando los datos presentados a continuación, determine las dos abundancias isotópicas faltantes, asumiendo que no existen otros isótopos estables en la muestra.
| Isótopo | Masa atómica (uma) | % Abundancia |
| 54Fe | 53.9396105 | ? |
| 56Fe | 55.9349375 | 89,9373 |
| 57Fe | 56.9353940 | 2,0770 |
| 58Fe | 57.9332756 | ? |
Solución
A diferencia del problema anterior, en este caso se posee de antemano la masa atómica promedio y las abundancias de dos de los cuatro isótopos del hierro. La fórmula de la masa atómica promedio no será suficiente para determinar la abundancia de los dos isótopos faltantes, ya que dicha ecuación tendría dos incógnitas.
Para poder resolver el problema, debemos, entonces, encontrar alguna otra relación matemática entre las variables involucradas, para poder así establecer un sistema de ecuaciones que nos permita obtener ambas incógnitas. En este caso, la segunda ecuación consiste en la suma de las abundancias de todos los isótopos, la cual debe ser de 100%.
Así que establecemos el siguiente sistema de ecuaciones:

Este sistema de ecuaciones se puede resolver fácilmente por medio de los siguientes pasos:
- Se linealiza la primera ecuación multiplicando ambos miembros por 100.

- Se resuelve la segunda para cualquiera de las dos incógnitas (%A54Fe o %A58Fe).



- Se sustituye la expresión obtenida en el paso anterior en la primera ecuación.


- Se resuelve la primera ecuación para la segunda incógnita y se calcula su valor.


- Se sustituye el valor de la incógnita calculada en el paso anterior en la expresión de la primera incógnita y se calcula su valor:
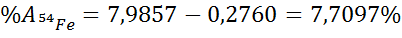

Como se puede ver, la abundancia del isótopo 54 del hierro en el asteroide resultó ser del 7,7097%, lo cual es considerablemente mayor que la abundancia de 5,845% de este isótopo en la Tierra.
Referencias
Chang, R. (2021). Química (Novena ed.). Mcgraw-Hill.
García, S. A. (n.d.). Tabla de Isotopos. Universidad de Antioquia. http://sergioandresgarcia.com/pucmm/fis202/4.TI.Tabla%20de%20isotopos%20naturales%20y%20abundancia.pdf
Gaviria, J. M. (2013, August 9). Cálculo de las abundancias relativas de los isótopos del carbono. TRIPLENLACE. https://triplenlace.com/2013/08/09/calculo-de-las-abundancias-relativas-de-los-isotopos-del-carbono/
Los isótopos y la espectrometría de masas (artículo). (n.d.). Khan Academy. https://es.khanacademy.org/science/ap-chemistry-beta/x2eef969c74e0d802:atomic-structure-and-properties/x2eef969c74e0d802:mass-spectrometry-of-elements/a/isotopes-and-mass-spectrometry



