Tabla de Contenidos
La entalpía (H) es una propiedad termodinámica definida como la suma de la energía interna de un sistema termodinámico (U) y el producto de su presión y su volumen (PV). Es decir, la entalpía se define como:

Esta propiedad se caracteriza por ser una función de estado. Esto significa que el valor de la entalpía de un sistema en un momento dado depende únicamente del estado en el que se encuentre y no del estado inmediatamente anterior ni del que vendrá después. Es decir, la entalpía no depende del camino que llevó al sistema al estado en el que se encuentra, sino únicamente de cuál es el estado actual.
El cambio de entalpía
La definición de la entalpía como una función de estado tiene varias implicaciones. Una de ellas es que, cuando un sistema se somete a un cambio de estado, este cambio puede a su vez implicar un cambio en la entalpía del sistema. En otras palabras, cada proceso al que se somete un sistema tiene asociado un cambio o variación de la entalpía; esta variación se denota como ΔH y puede ser positiva, negativa o incluso cero.
Debido a la forma como se define la entalpía, y como consecuencia de la primera ley de la termodinámica, la variación de entalpía de un proceso en que el sistema solo lleva a cabo trabajo de expansión a presión constante es igual al calor que dicho sistema absorbe. En otras palabras, en ausencia de otros tipos de trabajo,
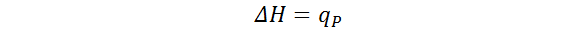
Donde qP es el calor que absorbe el sistema durante un proceso a presión constante. Este resultado es de gran importancia porque una gran cantidad de reacciones químicas ocurren a presión constante; por ello, la medición experimental de la cantidad de calor liberado o absorbido durante estos procesos permite medir indirectamente el cambio de la entalpía del sistema.
Esta característica da origen a lo que se conoce como termoquímica, que no es más que la parte de la termodinámica (o de la química) que estudia las transferencias de calor ocasionadas por la ocurrencia de reacciones químicas.
La ley de Hess
La segunda implicación de que la entalpía sea una función de estado se expresa en forma de la ley de Hess. En relación a las reacciones químicas, esta ley dice que “cuando los reactivos se convierten en productos, el cambio de entalpía es el mismo independientemente de que se efectúe la reacción en un solo paso o en una serie de pasos.” Esto quiere decir que si partimos del reactivo A y terminamos con el producto B, el ΔH de dicha reacción es independiente de la forma en que haya ocurrido la reacción. Esto, a su vez, implica que podemos calcular el ΔH de una reacción simplemente sumando los valores de ΔH de un conjunto de reacciones que logre transformar a los mismos reactivos en los mismos productos. Esta última es una de las prácticas más comunes en la termoquímica y es justamente de lo que trata el siguiente problema de muestra.
Problema resuelto del cálculo del cambio de entalpía de una reacción utilizando la ley de Hess
Enunciado:
Calcule el cambio de entalpía de la siguiente reacción utilizando la Ley de Hess,

dadas las entalpías de las siguientes reacciones:


Solución
Para calcular la variación o cambio de entalpía utilizando la ley de Hess, hay que buscar una manera de combinar las ecuaciones químicas que nos dan como datos para que, al sumarlas, den como resultado la ecuación de la reacción química cuyo cambio de entalpía queremos calcular.
Esto implica manipular las ecuaciones químicas de distintas maneras, incluyendo invertirlas, multiplicarlas por valores constantes o dividirlas entre valores constantes. Lo más importantes a tener en cuenta es que todo lo que se le haga a la ecuación química hay que hacérselo también a su valor de ΔH. Es decir que:
- Al invertir o voltear una ecuación termoquímica se debe invertir también el signo de su cambio de entalpía.
- Al multiplicar una ecuación entera por una constante, entonces el cambio de entalpía también debe multiplicarse por la misma constante.
- Al dividir una ecuación química entre una constante, entonces el cambio de entalpía también debe dividirse entre la misma constante.
Veamos los pasos necesarios para aplicar estos principios de manera efectiva:
Paso 1: Ubicar los reactivos y productos que aparecen en las reacciones dadas del lado correcto de la ecuación
Una estrategia general que se puede aplicar en la mayoría de estos problemas es buscar uno a uno los reactivos y productos de la reacción incógnita, es decir, aquella cuya entalpía queremos calcular, en todas las reacciones que nos dan como datos. Luego, hay que asegurarse de que el compuesto que nos interesa esté del lado correcto de la ecuación; de lo contrario, se invierte la ecuación.
Por ejemplo, en el presente problema, estamos interesados en que el aluminio elemental y el óxido férrico aparezcan entre los reactivos de las reacciones cuyas entalpías conocemos. Como se puede observar, esto implica invertir ambas ecuaciones, así como invertir el signo de sus variaciones de entalpía:


Al invertir estas ecuaciones se pueden ubicar los reactivos del lado en el que los necesitamos, pero al mismo tiempo ubicamos los productos del lado correcto. Sin embargo, aún no está listo el proceso ya que, como se puede observar, la suma de estas dos reacciones no da la reacción requerida.
Paso 2: Multiplicar o dividir los coeficientes estequiométricos cuando sea necesario
Se debe entender que se quiere que la suma de las ecuaciones químicas dadas dé la ecuación incógnita. Esto implica que toda especie que no aparezca en la última debe cancelarse y todas las demás especies debe poseer los coeficientes estequiométricos adecuados.
En nuestro problema se puede ver que las reacciones dadas como datos involucran al oxígeno molecular, el cual no está presente en la reacción que buscamos, así que debemos asegurarnos de que se cancele al momento de sumar las ecuaciones. Para que esto suceda y, además, para que los coeficientes del hierro y del óxido férrico sean correctos, hay que dividir la segunda ecuación entre 2, así como también su entalpía. Es decir:
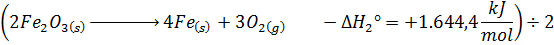
Lo cual da como resultado:

Paso 3: Sumar las ecuaciones
Al tener todos los reactivos y productos del lado correcto y con los coeficientes correctos, se pueden sumar las ecuaciones y sus respectivas entalpías, para así obtener la entalpía que buscamos:



Finalmente, tenemos que el cambio de entalpía de la reacción es:


Respuesta:
La reacción entre el aluminio y el óxido férrico para dar hierro y óxido de aluminio tiene un cambio de entalpía estándar de -845,6 kJ/mol.
Referencias
- Atkins, P., & de Paula, J. (2008). Química Física (8.a ed.). Editorial Médica Panamericana.
- Britannica, The Editors of Encyclopaedia. (2020, 9 abril). Enthalpy | Definition, Equation, & Units. Encyclopedia Britannica. https://www.britannica.com/science/enthalpy
- Chang, R., & Goldsby, K. (2013). Química (11.a ed.). McGraw-Hill Interamericana de España S.L.
- Redacción Conceptodefinicion.de. (2020, 16 diciembre). Ley de Hess. Concepto de – Definición de. https://conceptodefinicion.de/ley-de-hess/
- Suárez, T., Fontal, B., Reyes, M., Bellandi, F., Contreras, R., & Romero, I. (2005). Principios de Termoquímica. VII Escuela Venezolana para la Enseñanza de la Química. http://www.saber.ula.ve/bitstream/handle/123456789/16744/termoquimica.pdf?sequence=1&isAllowed=y



