Tabla de Contenidos
La presión osmótica (Π) se refiere a la presión que se debe aplicar a una disolución para frenar la ósmosis de disolvente a través de una membrana semipermeable desde un reservorio de disolvente puro. Esta es una propiedad coligativa de las disoluciones que resulta de gran importancia en distintos campos.
La presión osmótica es particularmente relevante en los campos de la biología y la medicina, ya que esta regula el equilibrio hídrico de las células que conforman a todos los seres vivos. Por otro lado, la presión osmótica también es importante en el campo de la ingeniería porque representa la presión mínima que se debe aplicar a una disolución para poder llevar a cabo la ósmosis inversa, procedimiento que forma la base de la desalinización del agua de mar.
En cualquiera de estos casos es esencial poder calcular la presión osmótica de diferentes disoluciones. Por esta razón, a continuación se presenta un problema de cálculo de la presión osmótica de una disolución acuosa compleja, es decir, que contiene varios solutos, algunos iónicos y otros no.
Por otro lado, también es importante poder determinar la concentración que se requiere para alcanzar determinada presión osmótica para así poder preparar soluciones hipertónicas, hipotónicas o isotónicas según sea necesario. También se presenta la solución de un problema que trata este punto.
¿Cómo se calcula la presión osmótica?
El cálculo de la presión osmótica de una disolución se lleva a cabo utilizando la siguiente fórmula:
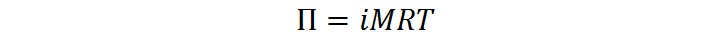
Donde Π es la presión osmótica en atmósferas, i es el coeficiente de van’t Hoff, M es la concentración molar del soluto, R es la constante de los gases ideales cuyo valor es de 0,08206 atm.L/mol.K y T es la temperatura absoluta en kelvin.
En el caso de varios solutos, la presión osmótica total se calcula como la sumatoria de las contribuciones de cada soluto, es decir:
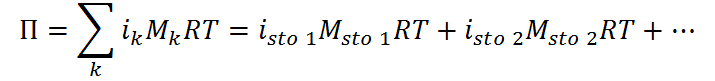
Los valores de los coeficientes de van’t Hoff se pueden determinar de forma teórica (aproximada) a partir del número de partículas en las que se disocia el soluto si se trata de un electrolito fuerte, o de la resolución del equilibrio iónico en el caso de los electrolitos débiles.
Sin embargo, el valor más adecuado es aquel que se determina por medio de experimentos como el descenso crioscópico o el ascenso ebulloscópico de una disolución.
Problema 1: Cálculo de la presión osmótica de una disolución compleja
Enunciado
Se desea calcular la presión osmótica, en milímetros de mercurio, de una disolución preparada disolviendo 5,00 g de glucosa, 0,500 g de cloruro de sodio y 0,200 g de cloruro de calcio en suficiente agua para preparar 250 ml de solución a 25 °C.
Solución
La solución de este tipo de problemas se lleva a cabo por medio de los siguientes pasos:
Paso 1: Extraer los datos del enunciado, transformar las unidades y calcular las masas molares relevantes.
El primer paso, como en todos los problemas, consiste en obtener los datos del enunciado. En este caso se nos proporcionan las masas de tres solutos, el volumen total de la disolución y la temperatura. Además, se indica que los solutos son glucosa (fórmula C6H12O6), cloruro de sodio (NaCl) y cloruro de calcio (CaCl2).
La siguiente tabla resume los datos proporcionados. En vista de que se calcularán concentraciones molares, se requiere el volumen en litros. Las masas molares se calcularon sumando las masas molares de cada átomo presente en la fórmula, como es normal.
| mglucosa = | 5,00 g | MMglucosa = | 180,16 g/mol |
| mNaCl = | 0,500 g | MMNaCl = | 58,44 g/mol |
| mCaCl2 = | 0,200 g | MMCaCl2 = | 110,98 g/mol |
| Vdisol = | 250 mL x (1L/1000mL) = 0,250 L | T = | 25 °C + 273,15 = 298,15 K |
Paso 2: Calcular la concentración molar de todos los solutos.
Esta disolución contiene 3 solutos, así que se deben calcular 3 molaridades. Estas son:
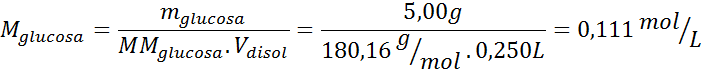
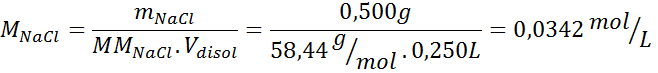
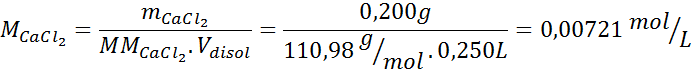
Paso 3: Determinar el factor de van’t Hoff de cada soluto.
Como se mencionó al principio, estos factores pueden determinarse experimentalmente o deforma teórica. En el presente caso, lo haremos de forma teórica.
Glucosa
Por tratarse de un soluto molecular que no se disocia, el factor de van’t Hoff de la glucosa es i=1.
Cloruro de sodio
El NaCl es un soluto iónico y además es un electrolito fuerte. En este caso, el factor de van’t Hoff viene determinado por el número total de iones o partículas en los cuales se disocia el soluto en la disolución. La siguiente es la reacción de disolución de este soluto:
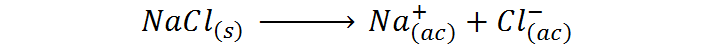
Como podemos observar, cada fórmula de NaCl que se disocia produce un total de dos iones, por lo que para este soluto i=2.
Cloruro de calcio
Al igual que en el caso anterior, el cloruro de calcio consiste en un soluto iónico que se disocia completamente en disolución acuosa. La reacción de disociación es:
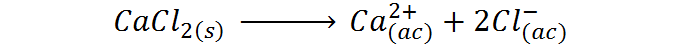
A diferencia del cloruro de sodio, el cloruro de calcio produce tres iones al disociarse, por lo que tiene un factor de van’t Hoff teórico de i=3.
Paso 4: Utilizar la fórmula para determinar la presión osmótica.
El último paso consiste en determinar la presión osmótica propiamente dicha. El resultado inicial estará expresado en atmósferas, así que luego lo tendremos de transformar a mmHg, como especifica el enunciado.
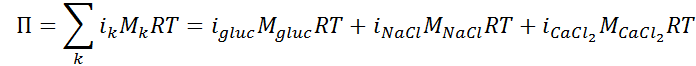
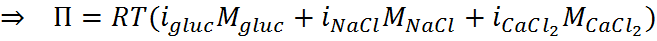
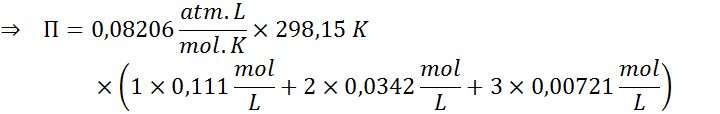
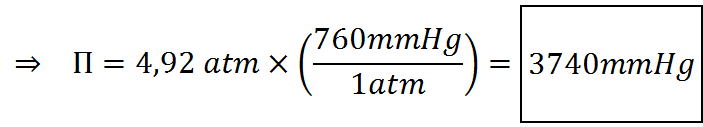
Respuesta
La solución tendrá una presión osmótica de 3.740 mmHg.
Problema 2: Cálculo de concentración a partir de la presión osmótica
Enunciado
Determine la masa de cloruro de calcio necesaria para preparar 100 mL de disolución con una presión osmótica de 380 Torr a 37 °C.
Solución
Este tipo de problemas se ataca de una manera similar al anterior. Lo único que cambia es el uso de la ecuación de la presión osmótica, la cual se debe resolver para obtener la incógnita deseada, en este caso la concentración del soluto, en lugar de utilizarse directamente.
Paso 1: Extraer los datos del enunciado, transformar las unidades y calcular las masas molares relevantes.
El primer paso es el mismo que en el caso anterior.
| Vdisol = | 100 mL x (1L/1000mL) = 0,100 L | T = | 37 °C + 273,15 = 310,15 K |
| Π = | 380 Torr . (1atm/760 Torr) = 0,500 atm | MMCaCl2 = | 110,98 g/mol |
| mCaCl2 = | ? |
Paso 2: Determinar el factor de van’t Hoff
Como vimos en el problema anterior, por tratarse de un electrolito fuerte que produce tres iones al disociarse, el factor de van’t Hoff del cloruro de calcio es i=3.
Paso 3: Despejar y calcular la concentración molar del soluto.
Ya que se trata de un solo soluto, la presión osmótica viene dada por:
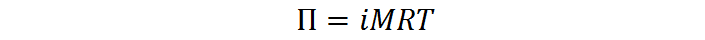
Ya conocemos los valores de todas las variables a excepción de la concentración molar, así que podemos resolver esta ecuación para dicha variable:
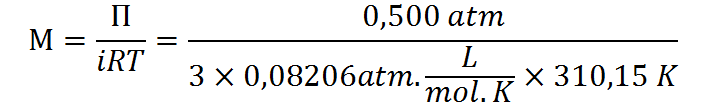
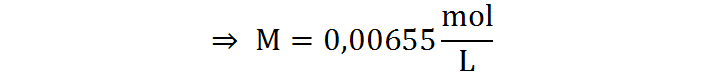
Paso 4: Utilizando la fórmula de molaridad, despejar la masa de soluto.
La fórmula de molaridad o concentración molar es:
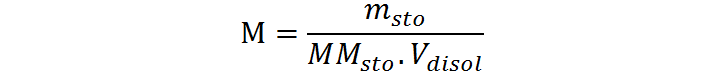
Al resolver esta ecuación para la masa del soluto, msto, se obtiene:
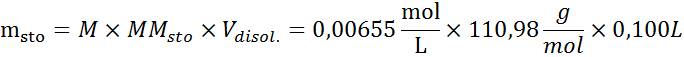
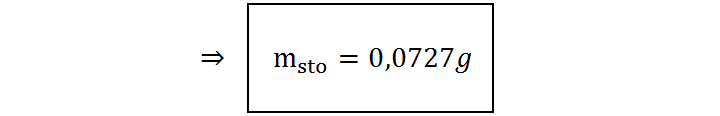
Respuesta
Se deben pesar 0,0727 g de cloruro de calcio para preparar 100 mL de una disolución que tenga una presión osmótica de 380 Torr a una temperatura de 37 °C.
Referencias
- Castro, S. (2019). Presión osmótica Fórmula y ejercicios resueltos. Profesor10demates. https://www.profesor10demates.com/2018/12/presion-osmotica-formula-y-ejercicios-resueltos.html
- Chang, R. (2021). Química (Novena ed.). Mcgraw-Hill.
- Presión osmótica. Qué es, Formula y Ejemplos. (2020). Núcleo Visual. https://nucleovisual.com/presion-osmotica-que-es-y-como-calcular/
- Zapata, M. (2020). Propiedades Coligativas: Presión Osmótica. Química en casa.com. https://quimicaencasa.com/propiedades-coligativas-presion-osmotica/



