Tabla de Contenidos
El agua es una molécula polar porque posee dos enlaces polares O-H cuyos momentos dipolares no se cancelan entre sí. Dichos momentos dipolares apuntan hacia el oxígeno y se suman para darle a la molécula un momento dipolar neto.
Esta polaridad es la responsable de muchas de las propiedades características del agua, incluidas parte de su reactividad química, sus puntos de fusión y ebullición y su capacidad de actuar como disolvente universal para solutos iónicos y polares, entre otras.
Dicho de otra forma, la polaridad del agua, así como la de cualquier otra molécula, es una consecuencia directa de la polaridad de sus enlaces, así como de la geometría molecular. Entender estos dos conceptos y cómo se aplican a la molécula del agua dará una idea más completa acerca de la polaridad de las moléculas.
¿Qué es un enlace polar?
Un enlace polar es un tipo de enlace covalente en el cual uno de los dos átomos es más electronegativo que el otro, por lo que atrae con más fuerza la densidad electrónica del enlace. La consecuencia de esto es que los electrones no se comparten de forma equitativa. El átomo más electronegativo adquiere una carga parcial negativa (identificada por δ-), mientras que el otro adquiere una carga parcial positiva (identificada por δ+).
Ambas cargas parciales son de igual magnitud y de signo opuesto, lo que convierte a los enlaces polares en dipolos eléctricos.
El que dos átomos formen o no un enlace covalente polar depende de la diferencia entre sus electronegatividades. Si la diferencia es demasiado grande, el enlace será iónico, pero si es muy pequeña o es nula, será un enlace covalente puro. Finalmente, el enlace será covalente polar si la diferencia es intermedia. Los límites para cada caso se presentan en la siguiente tabla:
| Tipo de enlace | Diferencia de electronegatividad | Ejemplo |
| Enlace iónico | >1,7 | NaCl; LiF |
| Enlace polar | Entre 0,4 y 1,7 | O-H; H-F; N-H |
| Enlace covalente no polar | < 0,4 | C-H; C-I |
| Enlace covalente puro | 0 | H-H; O-O; F-F |
El momento dipolar
Los enlaces polares se caracterizan por el momento dipolar. Este es un vector denotado con la letra griega μ (mu) que apunta a lo largo del enlace en la dirección del átomo más electronegativo. La magnitud de este vector viene dada por el producto de la magnitud de la carga separada, que es proporcional a la diferencia de las electronegatividades, y la distancia entre las dos cargas, es decir, la longitud del enlace.
El momento dipolar es esencial para comprender por qué el agua es polar, ya que la polaridad total de una molécula viene de la suma vectorial de todos sus momentos dipolares.
Geometría molecular
La geometría de una molécula indica la forma como están distribuidos sus átomos en torno a un átomo central. Por ejemplo, en el agua, el átomo central es el oxígeno, así que la geometría molecular indica cómo están orientados los dos átomos de hidrógeno alrededor del oxígeno.
Existen diferentes maneras de determinar la geometría molecular. La más sencilla es a través de la teoría de repulsión de pares de electrones de valencia, que establece que los pares de electrones que rodean al átomo central (sean enlazantes o pares de electrones libres) se orientarán para quedar lo más alejados posible el uno del otro.
Después de determinar cómo se distribuyen los electrones en torno al átomo central, la geometría se determina viendo hacia dónde apuntan los enlaces (sin tener en cuenta los pares de electrones libres).
Comprendidos estos dos conceptos, pasemos ahora a analizar a la molécula de agua, sus enlaces y su geometría:
Los enlaces O-H del agua son enlaces polares
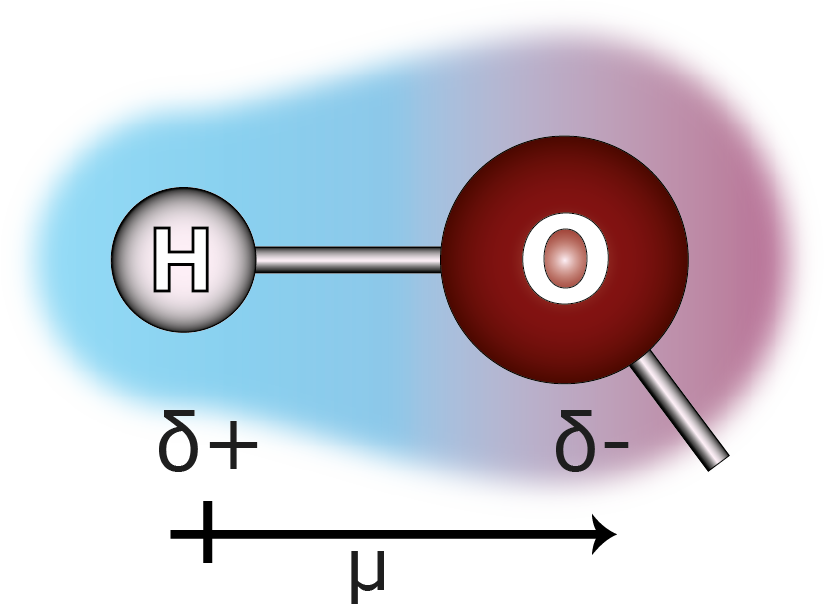
El agua posee dos átomos de hidrógeno enlazados a un átomo de oxígeno. La diferencia de electronegatividad entre el oxígeno y el hidrógeno es de 1,24, lo que hace que sea un enlace bastante polar (ver tabla anterior). En la figura de arriba se ilustra el momento dipolar de este enlace. Se debe tomar nota del hecho que el vector se suele dibujar a un lado del enlace para facilitar su visualización; no obstante, en realidad coincide con el enlace O-H, apuntando desde el núcleo del hidrógeno hacia el núcleo del oxígeno.
La molécula de agua tiene geometría angular
En la molécula de agua, el átomo de oxígeno presente hibridación sp3 y está rodeado por cuatro pares de electrones (los dos pares de los enlaces con hidrógeno y dos pares sin compartir). La teoría de repulsión de pares de electrones de valencia indica que cuatro pares de electrones apuntarán hacia los extremos de un tetraedro regular. En otras palabras, los dos átomos de hidrógeno apuntarán hacia dos de las cuatro esquinas de un tetraedro, lo que hace que la molécula de agua sea una molécula angular.
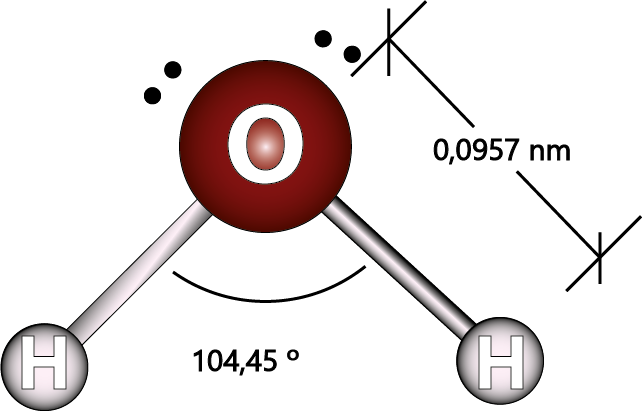
El ángulo entre los dos enlaces debería ser un ángulo tetraédrico de 109,5º, pero los dos pares de electrones libres repelen a los electrones de los enlaces con mayor fuerza, cerrando levemente el ángulo. El resultado es que los dos enlaces O-H en el agua forman un ángulo de 104,45º como se muestra en la figura anterior.
Enlaces polares + geometría angular = molécula polar
Es importante reconocer el hecho de que poseer enlaces polares no asegura que una molécula sea polar. De hecho, el dióxido de carbono posee dos enlaces polares, pero sus momentos dipolares se anulan entre sí. Por esta razón, la molécula es apolar.
Esto no sucede con la molécula del agua, ya que no es lineal sino angular. Ahora que tenemos una visión clara de las características de la molécula del agua, podemos pasar a determinar el momento dipolar neto de la molécula. Esto se hace dibujando ambos momentos dipolares encima de la molécula, y luego llevando a cabo la suma vectorial:

La suma se puede llevar a cabo de forma gráfica, utilizando el método del paralelogramo, como se muestra en la parte derecha de la figura anterior. Como se puede ver, ambos momentos dipolares producen un momento dipolar neto que apunta hacia el oxígeno pasando por el centro de la molécula.
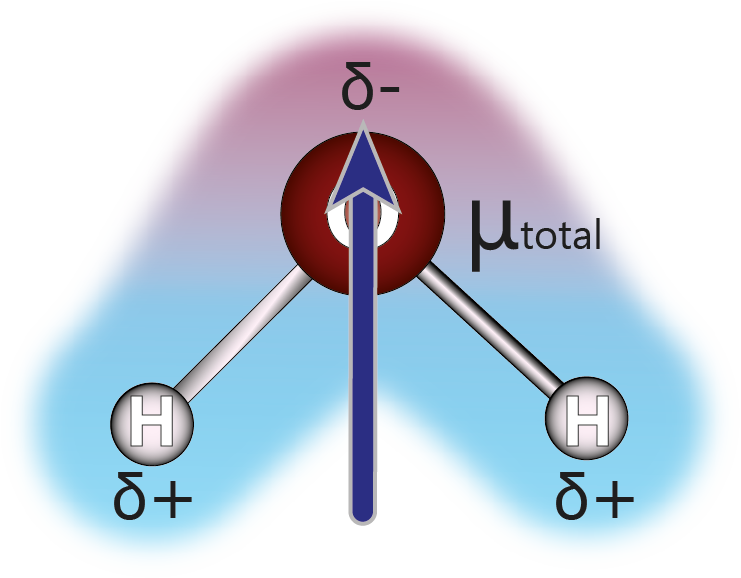
Finalmente, este momento dipolar neto es la razón por la cual el agua es una molécula polar.



