Tabla de Contenidos
Toda reacción química involucra uno o más reactivos que se transforman en uno o más productos por medio de un proceso de rompimiento y formación de enlaces químicos. Este proceso se representa por escrito de manera resumida por medio de la ecuación química.
Así como el proceso de cambio que ocurre durante una reacción química debe cumplir ciertas leyes naturales tales como la ley de conservación de la materia y la ley de conservación de la energía, entre otras, la ecuación química debe reflejar también el cumplimiento de dichas leyes. Por eso es necesario llevar a cabo el ajuste o balanceo de toda ecuación química, para así asegurar que la materia esté equilibrada en ambos lados de la ecuación, cumpliendo así con le ley de conservación de la materia.
Además de conservarse la masa, también es esencial que se conserven los átomos particulares que intervienen en la reacción, ya que las reacciones químicas solo involucran reordenamiento de los electrones de valencia de los átomos, más no implican cambios en sus núcleos. Por esta razón, todos los átomos que estaban presentes antes de ocurrir una reacción química debe seguir estando presentes después de que esta ocurra.
Asegurarse de que lo anterior ocurra es en lo que consiste equilibrar una ecuación química. En el presente artículo, presentamos tres métodos diferentes para llevar a cabo el balanceo o equilibrado de ecuaciones de distintos tipos.
Método 1: Equilibrar ecuaciones químicas por tanteo
Este es el método más simple para equilibrar ecuaciones químicas. Es el método por excelencia a utilizar siempre que estemos en presencia de reacciones relativamente simples en las que no hay varios reactivos o productos que contengan elementos repetidos.
Para entender mejor el proceso de equilibrado de ecuaciones por tanteo, tomaremos como ejemplo la reacción de combustión del butano (C4H10) en presencia de oxígeno gaseoso (O2) para formar dióxido de carbono (CO2) y agua (H2O).
El balanceo por tanteo consiste en los siguientes pasos:
Paso 1: Escribir la ecuación química sin equilibrar.
Se deben escribir los reactivos a la izquierda separados por signos + y todos los productos a la derecha de la flecha de reacción separados también por un signo +. En nuestro ejemplo, el butano y el oxígeno son los reactivos mientras que el dióxido de carbono y el agua son los productos:
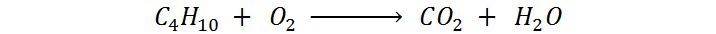
Debemos verificar que todas las fórmulas estén bien escritas, teniendo cuidado en utilizar bien cualquier paréntesis que pueda tener.
Paso 2: Hacer una lista de todos los elementos que hay de cada lado de la ecuación.
En este paso debemos verificar que no haya elementos en los reactivos que no estén en los productos y viceversa. Si esto ocurre, se debe a un error en la ecuación inicial, probablemente debido a alguna especie que interviene en la reacción que no colocamos.
| Reactivos | Productos |
| C | C |
| H | H |
| O | O |
Como se puede observar en este caso, todos los elementos están presentes en ambos lados de la ecuación.
Paso 3: Contar los átomos de cada elemento que hay en cada lado.
En este punto se desea verificar si la ecuación está equilibrada o no. De estarlo, entonces no hará falta hacer más nada. Si no, entonces se procederá al siguiente paso.
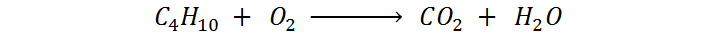
| Reactivos | Productos |
| C = 4 | C = 1 |
| H = 10 | H = 2 |
| O = 2 | O = 3 |
Como podemos ver, ninguno de los tres elementos presentes (C, H y O) están equilibrados, así que pasamos al siguiente paso.
Paso 4: Equilibrar añadiendo coeficientes estequiométricos antes de las fórmulas químicas de las distintas especies.
Este es el paso más importante. En primer lugar, debemos balancear o equilibrar un elemento a la vez. Esto se logra multiplicando cada fórmula por un número entero adecuado que equilibre los átomos de cada lado.
Es importante notar que nunca debemos modificar los subíndices de las fórmulas para equilibrar una ecuación, ya que esto cambiaría la fórmula y, por lo tanto, la identidad de la sustancia.
Además, también debemos recordar que el ajuste se hace de a un elemento por vez, inclusive si al agregar coeficientes a la ecuación altere los demás elementos. La clave está en el orden en el que se balancean los distintos elementos. Algunos consejos útiles son:
- Cualquier elemento que aparezca en forma elemental pura en cualquiera de los dos lados de la ecuación se deja de último. Estos por lo general no alteran los demás elementos cuando los ajustamos. En el caso de nuestro ejemplo, esto implica dejar de último al oxígeno que aparece como oxígeno elemental en los reactivos.
- Es buena idea comenzar por aquellos elementos que solo aparecen una vez en cada lado. Los que se repiten (como el oxígeno) generalmente se balancean solos al equilibrar los demás elementos.
- Si en un punto del balanceo nos quedamos trancados, lo mejor es borrar los coeficientes y comenzar de nuevo, esta vez comenzando por otro elemento.
- De ser necesario, se pueden utilizar fracciones en los coeficientes durante el proceso de equilibrado, siempre y cuando al final se multiplique toda la ecuación por el denominador para eliminar cualquier coeficiente que no sea entero.
En nuestro ejemplo, podemos comenzar tanto con el C como con el H ya que ambos aparecen una sola vez en ambos lados de la ecuación. Para equilibrar los 4 carbonos de los reactivos, debemos multiplicar el CO2 por 4. Además, también multiplicamos al agua por 5 para completar los 10 H que hay en los reactivos.
Como podemos ver, en los productos hay 13 oxígenos mientras que en los reactivos hay solo 2. Como no hay ningún número entero que multiplicado por 2 de 13, entonces utilizaremos una fracción que en el denominador tendrá el número de O que necesitamos (13) mientras que en el denominador colocamos el número de O en la molécula de O2 (2). Por lo tanto, colocamos como coeficiente 13/2:

| Reactivos | Productos |
| C = 4 | C = 4×1= 4 |
| H = 10 | H = 2 x 5 = 10 |
| O = 2 x 13/2 = 13 | O = 4×2 + 5×1 = 13 |
En este punto ya la ecuación está equilibrada, pero tiene un coeficiente fraccionario, por lo que ahora multiplicamos toda la ecuación por 2 (el denominador de la fracción):
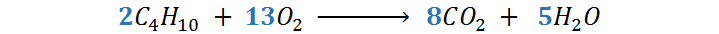
Que corresponde a la ecuación correctamente equilibrada.
Paso 5: Verificar nuevamente todos los elementos, así como la carga eléctrica.
Contamos una vez más todos los átomos de cada elemento en ambos lados de la ecuación. También es importante verificar que la carga eléctrica total en ambos lados de la ecuación también es igual, ya que también se debe cumplir la condición de conservación de la carga eléctrica.
Método 2: Ajuste algebraico
El método de ajuste o balanceo algebraico consiste en la solución del problema del equilibrado por medio del álgebra lineal, es decir, resolviendo un sistema de ecuaciones lineales interrelacionadas para hallar como incógnitas todos los coeficientes estequiométricos.
Este método sirve tanto para ecuaciones simples como complejas, tales como el en balanceo de la ecuación de una reacción de óxido reducción.
Tomaremos como ejemplo la reacción entre el ion permanganato y los iones yoduro para producir el catión manganeso (II), yodo molecular y agua en medio ácido (es decir, en presencia de iones H+). La ecuación sin ajustar es:

Los pasos para equilibrar esta ecuación utilizando el método algebraico son:
Paso 1: Agregar una letra distinta como coeficiente a todas las especies químicas presentes.
Puede tratarse de las letras a, b, c, … o podría utilizar las últimas letras del abecedario: x, y, z, …
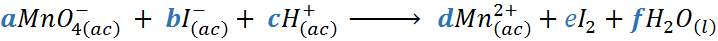
Paso 2: Escribir las ecuaciones de balanceo de masa y balanceo de cargas.
Este paso consiste en escribir un sistema de ecuaciones cuyas incógnitas sean los coeficientes estequiométricos. Las ecuaciones corresponden al alance de cada elemento por separado, más el balance de carga de la ecuación química:
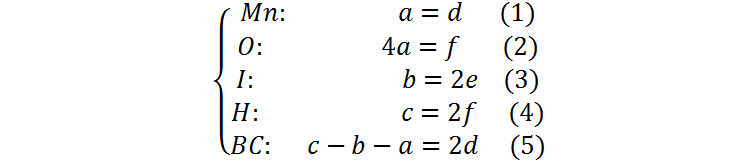
Paso 3: Resolver el sistema de ecuaciones
Como se puede observar, tenemos 6 incógnitas, pero solo 5 ecuaciones independientes. Esto quiere decir que tendremos que asignar el valor a una de las incógnitas nosotros mismos para poder así obtener todas las demás. Esto es de esperarse ya que existen infinitas combinaciones de coeficientes estequiométricos, tanto enteros como fraccionarios, que servirán para balancear la ecuación. Sin embargo, solo una de esas soluciones será la que posea los coeficientes enteros más bajos.
Este tipo de sistemas de ecuaciones son fáciles de resolver por sustitución, aunque cualquier método sirve. En nuestro caso, primero sustituiremos la ecuación (1) en todas las demás
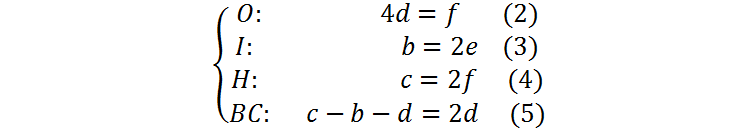
Ahora reemplazamos f = 4d de la ecuación (2) en todas las demás ecuaciones:
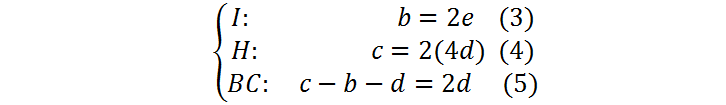
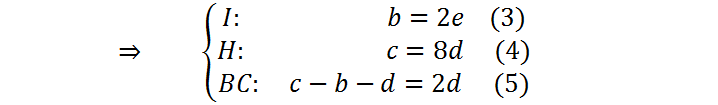
A continuación, sustituimos (3) y (4) en(5) para obtener:
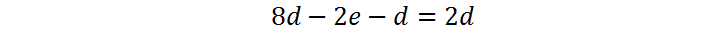
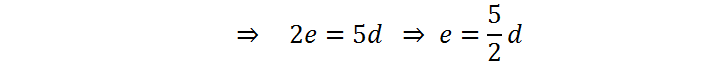
Ahora debemos asignar un valor arbitrario a la variable d. Con ello, tendremos el valor de e y también el de c, y así sucesivamente. Normalmente se asigna a la primera variable el valor de 1 para que todo sea más sencillo, pero como en este caso d está multiplicada por 5/2, es preferible seleccionar d = 2 para que e resulte un número entero:
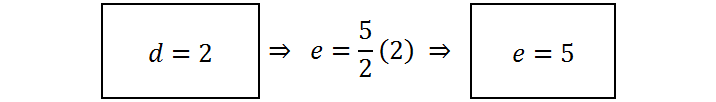
Ahora con d y e, vamos retrocediendo en las ecuaciones para calcular el resto de los coeficientes:
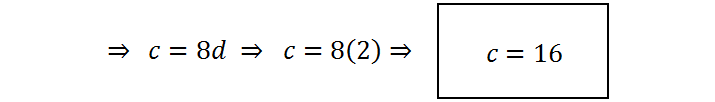

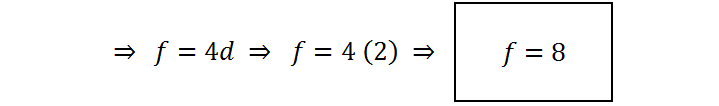
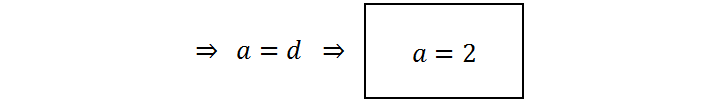
Resumiendo, los coeficientes son a = 2 ; b = 10 ; c = 16 ; d = 2 ; e = 5 ; f = 8. La ecuación balanceada queda, entonces:

Paso 4: Verificar que la ecuación esté ajustada
Contando los átomos de cada elemento podemos verificar que hay:
- 2 átomos de Mn de cada lado.
- 8 átomos de oxígeno de cada lado.
- 10 átomos de yodo de cada lado.
- 16 átomos de hidrógeno de cada lado.
- Hay una carga total de +4 en el lado izquierdo al igual que en el lado derecho.
Referencias
Chang, R. (2021). Química (11.a ed.). MCGRAW HILL EDDUCATION.
MIQ: Balanceo de ecuaciones químicas. (2020, 7 diciembre). campus.mdp.edu.ar. https://campus.mdp.edu.ar/agrarias/mod/page/view.php?id=3906
Regalado-Méndez, A., Delgado-Vidal, F. K., Martínez-López, R. E., & Peralta-Reyes, E. (2014). BALANCEO DE ECUACIONES QUÍMICAS INTEGRANDO LAS ASIGNATURAS DE QUÍMICA GENERAL, ALGEBRA LINEAL Y COMPUTACIÓN: UN ENFOQUE DE APRENDIZAJE ACTIVO. Formación universitaria, 7(2), 29–40. https://www.scielo.cl/scielo.php?script=sci_arttext&pid=S0718-50062014000200005
Timur : miembro planetcalc. (2020). Calculadora en línea: Balanceador de ecuaciones químicas. PlanetaCalc. https://es.planetcalc.com/6335/
Universidad de Guanajuato. (s. f.). CLASE 2 – Balanceo por el método algebraico. OA.UGTO.MX. https://oa.ugto.mx/oa/oa-rg-0001375/clase_2__balanceo_por_el_mtodo_algebraico.html



