Tabla de Contenidos
Una de las habilidades básicas relacionadas con la estequiometría consiste en la distinción entre los conceptos de número de átomos y número de moles. Ambos conceptos están íntimamente relacionados y comprenderlos es indispensable tanto para poder llevar a cabo cálculos correctamente como para interpretar correctamente la información de muchos textos de química y bioquímica.
¿Qué es un átomo?
Cuando hablamos de átomos, nos referimos a las unidades más pequeñas que conforman a un elemento químico determinado y que aún poseen las propiedades físicas y químicas del mismo. Los átomos son las pequeñas partículas que están formadas por un núcleo incluso más pequeño, donde podemos encontrar a los protones de carga positiva y a los neutrones; también están rodeados por un conjunto de electrones de carga negativa.
Estos átomos son los mismos átomos químicos que encontramos en la tabla periódica y que representamos en el papel por medio de sus respectivos símbolos químicos. Por ejemplo, podemos hablar de átomos de hidrógeno o átomos de carbono, en cuyo caso nos referimos a las partículas que conforman al elemento hidrógeno o carbono y que se representan con los símbolos H y C, respectivamente.
Las moléculas
Cuando dos o más átomos se unen entre sí por medio de enlaces covalentes, se forman nuevas unidades discretas denominadas moléculas. Así como los átomos se representan por medio de su símbolo químico, las moléculas se representan por la fórmula molecular, la cual es una lista de los símbolos de todos los átomos que la conforman, con subíndices que indican el número de átomos de cada elemento que está presente.
Ejemplo de una molécula: la sacarosa
Como ejemplo de una molécula podemos considerar a la sacarosa. Este compuesto es un disacárido formado por la unión de una molécula de glucosa y una de fructosa y posee la fórmula molecular C12H22O11. Su estructura se presenta a continuación:
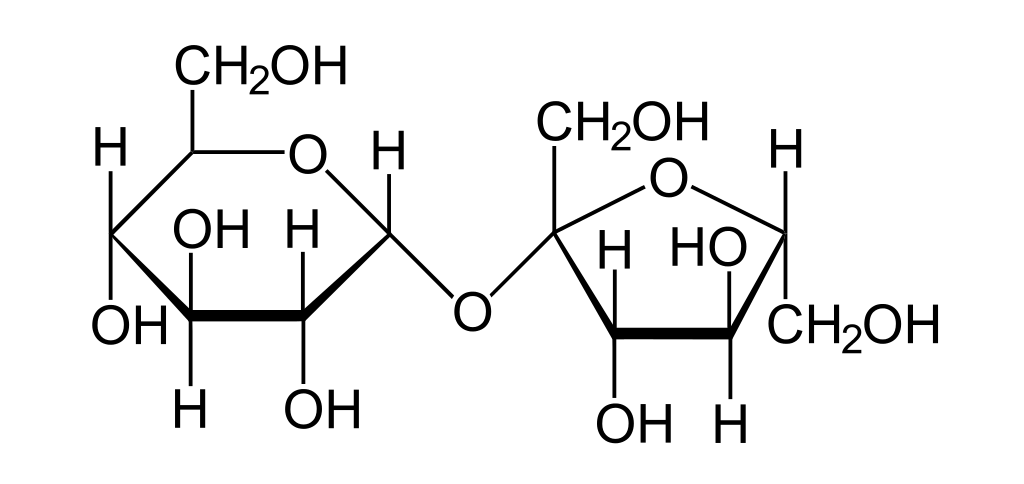
¿Cuántos átomos hay en la sacarosa?
Ahora que entendemos qué son los átomos y qué es la sacarosa, y además conocemos la fórmula molecular de esta última, podemos establecer algunas relaciones estequiométricas sencillas entre la sacarosa y los átomos que contiene:
- La sacarosa contiene tres tipos de átomos distintos, que son los átomos de carbono (C), hidrógeno (H) y oxígeno (O).
- Cada molécula de sacarosa contiene exactamente 12 átomos de carbono.
- Una molécula de sacarosa contiene exactamente 22 átomos de hidrógeno.
- Cada molécula de sacarosa contiene exactamente 11 átomos de oxígeno.
- En total, cada molécula de sacarosa contiene exactamente 45 átomos.
Además de estas relaciones entre una molécula de sacarosa y los átomos que contiene, también podemos establecer otras relaciones estequiométricas adicionales:
- En una muestra de sacarosa, por cada 12 átomos de carbono hay 22 átomos de hidrógeno.
- La sacarosa contiene 11 átomos de oxígeno por cada 12 átomos de carbono.
- Por cada 22 átomos de hidrógeno presentes en la sacarosa, también hay 11 átomos de oxígeno.
Cada una de estas proporciones se puede utilizar para llevar a cabo cálculos estequiométricos relacionados con la sacarosa. Además, este mismo análisis lo podemos hacer con cualquier sustancia cuya fórmula molecular conozcamos.
¿Qué es un mol?
El mol es la unidad del sistema internacional para expresar la cantidad de materia. Por ejemplo, al decir que tenemos un mol de nitrógeno, estamos expresando implícitamente cuántos átomos de este elemento tenemos. Esto se debe a que, cuando hablamos de moles, nos referimos a un número de Avogadro de algo. Es decir, el mol es un múltiplo que indica la presencia o existencia de 6,022 x 1023 unidades de alguna cosa. Esta cosa puede tratarse de lo que sea, aunque en el contexto de las ciencias, generalmente se refiere a átomos, moléculas, iones, electrones o simplemente partículas en general.
En otras palabras, el mol no es más que un número; uno muy grande, es cierto, pero un número, al fin y al cabo. De hecho, el concepto de mol es equivalente al de docena, un término que significa 12. Podemos decir que la docena es a 12, como el mol es al número de Avogadro.
El concepto de mol lo inventó Avogadro para establecer una escala de pesos atómicos relativos al peso de un átomo del isótopo 12 del elemento carbono. Se definió originalmente como el número de átomos de carbono presentes en exactamente 12 gramos de una muestra completamente pura de carbono-12. Años más tarde, se determinó que ese número era igual a 6,022 x 1023 y las determinaciones experimentales subsiguientes fueron afinando dicho número poco a poco. Sin embargo, para evitar que una de las unidades básicas del sistema internacional de unidades dependiera de la exactitud de las medidas experimentales y que, por lo tanto, sufriera una modificación cada vez que se obtuviera una mejor medición, se redefinió como exactamente 6,02214076 x 1023.
La importancia del mol
El mol es una unidad muy práctica de cantidad de materia, ya que nos permite expresar los números de átomos que hay en muestras macroscópicas de materia (que siempre son números extremadamente grandes) en forma de números más pequeños y manejables.
Por otro lado, gracias a que las proporciones entre los distintos elementos químicos que conforman a un compuesto químico son fijas, todas las proporciones estequiométricas que podemos establecer en términos de átomos, moléculas o iones, pueden establecerse utilizando los mismos números en términos de los moles de átomos, moles de moléculas o moles de iones.
Uso correcto e incorrecto del mol
Es común que, al toparse con los moles por primera vez, los estudiantes de química se sientan un poco confundidos. Esta confusión, en la mayoría de los casos, se debe a un uso incorrecto del término al expresar relaciones estequiométricas. Recordemos que el mol no es más que un número que cuenta cuántas unidades de algo hay; por lo tanto, siempre que hablemos de moles debemos especificar aquello que estamos contando.
Imaginemos por un momento que una persona le diga a otra “Tengo una docena”. A la segunda persona inmediatamente le surgirá una duda y le preguntará: ¿una docena de qué?
Lo mismo aplica para los moles. Si le decimos a un químico “cada litro de disolución contiene 3 moles”, el químico inmediatamente querrá saber ¿3 moles de qué? ¿De soluto? ¿De disolvente? ¿De disolución?
¿Cuántos moles hay en la sacarosa?
Aclarado lo anterior, podemos ahora establecer el mismo conjunto de relaciones estequiométricas que escribimos antes en términos de átomos y moléculas, pero ahora en términos de moles. Estas relaciones son:
- 1 mol de moléculas de sacarosa contiene exactamente 12 moles de átomos de carbono.
- 1 mol de moléculas de sacarosa contiene exactamente 22 moles de átomos de hidrógeno.
- Cada mol de moléculas de sacarosa contiene exactamente 11 moles de átomos de oxígeno.
- En total, cada mol de sacarosa contiene 45 moles de átomos.
- En una muestra cualquiera de sacarosa, por cada 12 moles de átomos de carbono hay 22 moles de átomos de hidrógeno.
- La sacarosa contiene 11 moles de átomos de oxígeno por cada 12 moles de átomos de carbono.
- Por cada 22 moles de hidrógeno presentes en la sacarosa, también hay 11 moles de oxígeno.
En estos ejemplos podemos notar que, a pesar de que es preferible hacerlo, en muchas situaciones no es necesario especificar el tipo de partículas o unidades de las que se trata, sino solo su nombre. Así, al decir “cada mol de sacarosa”, en vista de que la sacarosa es una molécula, se sobreentiende que el mol está contando moléculas de sacarosa.
De la misma manera, al decir “22 moles de hidrógeno” en este contexto, se entiende que el mol se refiere a moles de átomos de hidrógeno, ya que el hidrógeno es el nombre de un átomo. Sin embargo, se debe tener cuidado, ya que la palabra hidrógeno también se puede referir en otros contextos al hidrógeno elemental, el cual es un gas diatómico de fórmula H2. En estos casos, hablar de “moldes de hidrógeno” puede resultar ambiguo ya que no está claro si nos referimos a moles de moléculas de hidrógeno o a moles de átomos de hidrógeno, lo que resalta la necesidad de especificar en todo momento qué es lo que se está contando.
Número de átomos versus número de moles en la sacarosa
Las relaciones estequiométricas planteadas anteriormente no son las únicas que se pueden establecer para la sacarosa. También se pueden escribir relaciones que combinen número de átomos, iones o moléculas con número de moles de átomos, iones o moléculas. En estos casos, se debe tener cuidado en no olvidar que un mol equivale a un número de Avogadro.
Algunas posibles relaciones estequiométricas mixtas son:
- En un mol de moléculas de sacarosa hay 1,32454 x 1025 átomos de hidrógeno (lo que corresponde a 22 moles multiplicados por el número de Avogadro).
- Por cada 12 moles de átomos de carbono en una muestra de sacarosa, hay presentes 6,02214076 x 1023 moléculas de la misma.
Uno de los errores más comunes al momento de escribir relaciones estequiométricas para la sacarosa, así como para cualquier otro compuesto, es tratar al número de átomos y moléculas y al número de moles de átomos y moléculas como si fueran los mismos. A continuación, algunos ejemplos típicos de este tipo de error:
- En un mol de moléculas de sacarosa hay 22 átomos de hidrógeno.
- Por cada 12 átomos de carbono en una muestra de sacarosa, hay presentes 1 mol de moléculas de la misma.
Si en algún momento surge una duda de si una relación está bien o mal, un truco muy útil es reemplazar la palabra mol por docena. Si la relación tiene sentido al hacerlo, es probable que esté bien. Cuando la relación no está bien escrita, reemplazar mol por docena hará que suene mucho más extraño y será fácil darse cuenta de que hay un error. Por ejemplo, en la primera de las dos relaciones erróneas, decir en una docena de moléculas de sacarosa hay 22 átomos de hidrógeno evidentemente está mal, ya que una docena de moléculas tiene 12 veces 22 átomos de hidrógeno, es decir 264 átomos de hidrógeno, no 22.
Referencias
Los compuestos moleculares e iónicos. (2020, octubre 30). https://espanol.libretexts.org/@go/page/1807
Chang, R. (2021). Química (11.a ed.). MCGRAW HILL EDDUCATION.
Moles de átomos y moléculas – Conceptos – Estequiometría – Química. (s. f.). beUnicoos. https://www.beunicoos.com/quimica/estequiometria/moles-y-magnitudes-masicas/quimica-moles-de-atomos-y-moleculas
Redefinición del mol. (s. f.). LATU. https://www.latu.org.uy/wp/wp-content/uploads/2018/05/Redefinici%C3%B3n-del-mol.pdf



