Tabla de Contenidos
La difusión y la efusión son dos procesos relacionados que permiten comprender el comportamiento de los gases y de la materia en general a nivel molecular. La efusión es gobernada de manera bastante exacta por la ley de Graham, pero esta también permite describir de manera adecuada (aunque aproximada) al proceso de difusión, proporcionando un modelo que explica por qué algunos gases difunden más rápidamente que otros.
¿Qué es la difusión?
La difusión es el movimiento de partículas a través del espacio siguiendo su gradiente de concentración. Es decir, se trata del desplazamiento de cualquier tipo de partícula, sea esta un gas o un soluto en disolución, desde una región donde su concentración es mayor hacia otra donde su concentración es menor. La difusión es un proceso de gran importancia en multitud de contextos científicos, incluyendo la química, la física y la biología.
¿Qué es la efusión?
La efusión es el proceso mediante el cual un gas pasa de un compartimiento o recipiente a otro a través de un pequeño agujero u orificio. Para que el proceso se considere una efusión, el diámetro del agujero debe ser considerablemente menor que el camino libre medio de la partícula del gas. Este camino medio se refiere a la distancia media que puede recorrer una partícula en línea recta sin colisionar con otra partícula en las condiciones dadas de temperatura y presión.
La efusión es el proceso por medio del cual, por ejemplo, un globo lleno de helio se desinfla espontáneamente con el tiempo, o mediante el cual una bebida gaseosa sellada pierde casi todo su gas carbónico luego de transcurridos algunos años, a pesar de estar sellada «herméticamente».
La ley de Graham de la efusión
El físico escocés Thomas Graham estudió el proceso de efusión en 1846 y determinó experimentalmente que la tasa de efusión de un gas cualquiera es inversamente proporcional a la raíz cuadrada de la masa de sus partículas. Esto se puede expresar como:

Donde r representa la tasa de efusión a través de un pequeño agujero o poro y MM corresponde a la masa molar del gas (la letra r representa tasa en inglés, que se dice rate). Esta ley de proporcionalidad pasó a conocerse como la ley o la ecuación de Graham de la efusión, aunque también se le suele denominar ley o ecuación de Graham de la difusión porque también aplica para dicho fenómeno.
La tasa de efusión (r) indica el número de partículas que atraviesan el poro o agujero por unidad de tiempo. En el caso de efusión a través de una superficie porosa, en la cual hay millones de pequeños poros, la tasa de efusión puede referirse al número total de partículas (o a la masa del gas) que atraviesan la superficie porosa por unidad de área y por unidad de tiempo. En el contexto de la difusión, r indica la tasa de difusión y representa la cantidad de gas que difunde por unidad de área y por unidad de tiempo.
Relación de las tasas de efusión o difusión de dos gases
La fórmula de Graham también se puede expresar de una manera distinta para relacionar las tasas de efusión de dos gases diferentes bajo las mismas condiciones. Esto permite comparar, por ejemplo, cuál de los dos gases se escapa más rápidamente cuando ambos están contenidos en el mismo recipiente provisto de una superficie porosa. En este caso, la ley de Graham se escribe así:

Lo que esta ecuación indica es que, entre dos gases que se encuentren en las mismas condiciones, se escapará más rápidamente aquel que tenga las partículas más livianas. Además, la relación de las tasas de efusión varía en función de la raíz cuadrada de las masas de las partículas. Es decir, si un gas es 4 veces más pesado que otro, entonces difundirá a la mitad de la velocidad.
Explicación de la ley de Graham de la difusión y efusión
La ley de Graham es una ley empírica que se estableció originalmente en base a observaciones experimentales. En otras palabras, es la expresión matemática que relaciona la velocidad de efusión con la masa de las partículas. Sin embargo, el desarrollo de la teoría cinética de los gases permitió entender el origen de la fórmula de Graham, es decir, dicho modelo explica por qué los gases (ideales) cumplen con dicha ecuación.
Utilizando un modelo de esferas duras en el cual los gases solo colisionan por medio de colisiones elásticas, se determinó que la tasa de efusión depende de la velocidad de desplazamiento de las partículas, y esta, a su vez, es inversamente proporcional a la raíz cuadrada de su masa.
Aplicaciones de la ley de Graham de la difusión y efusión
Enriquecimiento isotópico de gases
La ley de Graham tiene dos campos de aplicación muy importantes. Por un lado, permitió el desarrollo de sistemas de enriquecimiento o purificación basados exclusivamente en el peso molecular de los gases. Al hacer pasar una mezcla de gases por una columna con paredes porosas, todos los gases de la mezcla tenderán a escaparse a través de los poros, pero las partículas más ligeras lo harán más rápidamente que las más pesadas, por lo que la mezcla del gas que escapa será más rica en estas partículas livianas.
Este es el principio de funcionamiento del sistema de enriquecimiento de uranio-235 que se utilizó en el Proyecto Manhattan para la fabricación de la primera bomba atómica. Para ser utilizable en la bomba, el uranio-235 debe enriquecerse a una concentración mucho mayor que el 0,7 % que contiene el uranio natural.

Para purificar este isótopo, se transforma todo el uranio de una muestra en el compuesto volátil hexafluoruro de uranio (UF6), el cual es vaporizado y la mezcla gaseosa se hace pasar por una cascada de columnas porosas. Como el 235UF6 es más liviano que el 238UF6, entonces el primero difunde más rápidamente que el segundo (siguiendo la ley de Graham) y la mezcla termina ligeramente enriquecida de uranio-235 tras cada paso por una columna.
Determinación de pesos moleculares
Otra aplicación de la ecuación de Graham es en la determinación experimental de pesos o masas moleculares. Si tenemos una mezcla de un gas conocido y otro desconocido y lo pasamos por una columna porosa, la mezcla resultante estará enriquecida en gas más liviano. Este enriquecimiento está determinado por la relación entre las tasas de efusión de los dos gases. En vista de que la fórmula de Graham relaciona estas tasas con la relación entre las masas molares, al conocer la masa molar de uno de ellos podemos utilizar la ecuación de Graham para calcular la masa molar del gas desconocido.
Ejemplos de cálculos con la ley de Graham de la difusión y efusión
Enriquecimiento de uranio.
Enunciado:
Sabiendo que la masa atómica relativa del uranio-235 es 235,04 y la del uranio-238 es 238,05, y que la masa atómica promedio de flúor es 18,998, determine la relación entre las tasas de efusión del 235UF6 y el 238UF6.
Solución:
Como estamos determinando la relación entre dos tasas de efusión, utilizaremos la ecuación de Graham. Para ello, necesitamos en primer lugar calcular las masas molares de ambos gases.


Utilizando estos valores, podemos determinar la relación entre las tasas de efusión:

Este resultado indica que, cada vez se hace pasar una mezcla de estos dos gases por una columna porosa, la mezcla de gases resultantes (la que escapa por los poros) contendrá una concentración relativa 1,0043 veces mayor que la que tenía antes.
Determinación de la masa molar de un gas desconocido.
Enunciado:
Supongamos que tenemos una mezcla equimolar de dos gases. Uno es dióxido de carbono (MM=44 g/mol) y el otro es un gas desconocido (MM=?). Si el dióxido de carbono difunde 3 veces más rápido que el gas desconocido, determine la masa molar de este último.
Solución:
En este caso, conocemos la relación entre las dos tasas de efusión, ya que al decir que el dióxido de carbono difunde 3 veces más rápido, lo que se quiere decir es que su tasa de difusión (o de efusión) es:

Ahora, aplicando la ley de Graham, podemos determinar la masa molar del gas desconocido:

Al resolver esta ecuación, obtenemos:
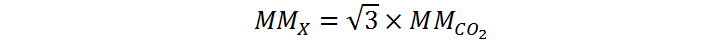

Por lo tanto, la masa molar del gas desconocido es de 76,21 g/mol.
Referencias
Academia Internet. (2018, 3 septiembre). Ley de Graham, Ley de difusión de los gases [Vídeo]. YouTube. https://www.youtube.com/watch?v=Fd-a35TPfs0
Atkins, P., & de Paula, J. (2010). Atkins. Química física (8.a ed.). Editorial Médica Panamericana.
Diffusion. (2021, 22 marzo). BYJUS. https://byjus.com/biology/diffusion/
Graham’s Laws of Diffusion and Effusion. (1 de septiembre, 2020). https://chem.libretexts.org/@go/page/41411
Lumen Learning. (s. f.). 8.4: Effusion and Diffusion of Gases | General College Chemistry I. Courses Lumenlearning. https://courses.lumenlearning.com/suny-mcc-chemistryformajors-1/chapter/effusion-and-diffusion-of-gases/
Ley de Graham | Efusion y Difusion de Gases. Quimica-Organica. Disponible en https://www.quimica-organica.com/ley-de-graham/.



