Tabla de Contenidos
Existen una gran cantidad de experimentos caseros que sirven para ilustrar muchos de los aspectos más importantes de la ciencia, y concretamente de la química. Uno de estos experimentos es el del hielo caliente,que consiste en la cristalización rápida y exotérmica de una disolución acuosa de acetato de sodio. A continuación, mostramos todo lo necesario para llevar a cabo la síntesis de acetato de sodio a partir de vinagre y bicarbonato de socio, y además prepararemos una disolución sobresaturada de esta sal orgánica que, al cristalizar, ilustrará el poder de las reacciones exotérmicas.
¿Qué es el hielo caliente?
A pesar de lo que sugiere el nombre, el hielo caliente en realidad no es hielo. Recordemos que el hielo no es más que el nombre común con el que se conoce al agua en estado sólido. En condiciones ambientales de temperatura y presión, el agua se encuentra en estado líquido y que su punto de fusión es de 0 °C. A la presión ambiental estándar de 1 atmósfera, no es posible calentar al hielo más allá de su punto de fusión, ya que cualquier calor adicional que suministremos se gastará derritiendo al hielo en lugar de calentándolo. Por esta razón, la idea de fabricar hielo verdadero (agua sólida) a presión ambiental y a temperatura ambiente o, peor, a una temperatura mayor, viola las leyes de la termodinámica. En otras palabras, es imposible.
El hielo caliente en realidad es un compuesto químico denominado acetato de sodio. Este compuesto es una sal orgánica formada por iones acetato, que corresponden a la base conjugada del ácido acético, contenido en el vinagre que utilizamos en la cocina, y iones sodio. El ácido acético es un ácido orgánico perteneciente a la familia de los ácidos carboxílicos y es el segundo miembro más simple de dicha familia. De allí que a sus sales se les denomine sales orgánicas.
La fórmula del acetato de sodio se puede escribir de distintas maneras. Su fórmula química es NaC2H3O2. En forma semidesarrollada se escribe CH3COONa, y a veces el ion acetato se abrevia Ac–, por lo que el acetato de sodio se representa como NaAc. La estructura química de este compuesto es:

A pesar de ser esta su estructura, el acetato de sodio cristaliza de disolución acuosa en forma de la sal trihidratada de fórmula NaC2H3O2 · 3 H2O.
Reacción de síntesis del acetato de sodio
Las sales se pueden sintetizar de diferentes maneras y a partir de diferentes reactivos químicos. Una de las formas más sencillas de hacerlo es por medio de la reacción de neutralización entre un ácido con el anión apropiado (ácido acético en este caso) y una base que contenga el catión apropiado. El ácido acético es un ácido débil que es fácil de conseguir y seguro de manipular. En cuanto a la base, existen varias opciones que funcionarían para obtener acetato de sodio, pero las dos más adecuadas son el hidróxido de sodio (soda cáustica) y el bicarbonato de sodio.
La primera base, el hidróxido de sodio, es una buena opción para llevar a cabo la síntesis de manera rápida debido a que es una base fuerte que reacciona rápidamente con el ácido acético para formar acetato de sodio y el producto secundario de la reacción es agua, la cual ya está presente de todas formas.
En este caso, la reacción química sería:

Sin embargo, esta reacción tiene dos grandes problemas. En primer lugar, a pesar de que el hidróxido de sodio se puede conseguir fácilmente, ya que es el componente principal de la mayoría de los limpiadores de horno y de los quita-grasa cáusticos, es una sustancia considerablemente peligrosa que debe manejarse con mucho cuidado.
En segundo lugar, se requiere medir con cuidad las cantidades de hidróxido de sodio agregadas a la disolución y se debería controlar el pH utilizando papel tornasol o algo similar para indicar cuándo se ha neutralizado todo el ácido acético, ya que, si se agrega un exceso de esta base, la disolución de la sal puede resultad fuertemente alcalina y peligrosa para manejar.
Una alternativa más adecuada y mucho más segura que proporciona los mayores beneficios del hidróxido de sodio, pero ninguna de las desventajas es el bicarbonato de sodio. Esta sal corresponde a la sal sódica de la base conjugada del ácido carbónico. Es un compuesto anfótero que puede reaccionar tanto con ácidos como con bases y es capaz de neutralizar al ácido acético, formando acetato de sodio y ácido carbónico. Este último podría interferir contaminando el acetato de sodio formado, pero el mismo rápidamente se descompone produciendo agua y dióxido de carbono gaseoso el cual se escapa rápidamente en forma de una efervescencia visible a simple vista.
La reacción de síntesis de acetato de sodio utilizando bicarbonato de sodio es:
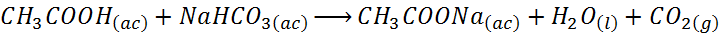
Esta es la reacción que utilizaremos en la presente síntesis de acetato de sodio.
El vinagre blanco es una disolución acuosa purificada de ácido acético que generalmente contiene entre 3% y 5% en masa del ácido. Con una densidad muy cercana a la del agua pura, esto quiere decir que 1 L de vinagre contiene aproximadamente entre 30 g y 50 g de ácido acético. Esto quiere decir que para que reaccionen en proporciones estequiométricas, un litro de vinagre requiere aproximadamente entre 42 g y 70 g de bicarbonato de sodio. De encontrarse en la máxima proporción, se formarían alrededor de 113 g de acetato de sodio trihidratado.
Procedimiento para preparar hielo caliente en casa
Reactivos
- 1 L Vinagre blanco (ácido acético de aprox. 5%)
- 100 g de bicarbonato de sodio
Materiales y equipos
- Estufa para calentar.
- Vaso de precipitado de por lo menos 1,5 L de capacidad. De no contar con uno, puede reemplazarlo con una olla o cacerola de vidrio y, en última instancia, de metal.
- Recipiente de vidrio de 200 a 250 mL de capacidad. El recipiente debe estar bien limpio y no debe estar rayado.
- Balanza de cocina, preferiblemente digital.
Preparación de disolución sobresaturada de acetato de sodio
Para sintetizar el acetato de sodio siga los siguientes pasos:
- Pese el bicarbonato en una balanza y resérvelo.
- Añada el vinagre al vaso de precipitado y agregue lentamente el bicarbonato de sodio a la disolución en pequeñas porciones y agitando con la ayuda de una cuchara hasta que se detenga la efervescencia antes de agregar la siguiente porción. Esto es para evitar que se genere demasiado dióxido de carbono y que se desborde por los costados del vaso de precipitado. En este punto ya se ha formado el acetato de sodio.
- Calentar la disolución hasta ebullición a fuego medio y seguir calentando para evaporar el agua y reducir el volumen hasta que aparezcan cristales de acetato de sodio en los bordes del recipiente. En este punto el volumen debería ser de aproximadamente unos 100 o 150 mL.
- En este punto, añada una pequeña cantidad de agua (unos 5 mL deberían ser suficientes) y continúe calentando hasta que se disuelva completamente todo el sólido formado.
- Cuidadosamente, transfiera la disolución caliente al segundo recipiente de vidrio. Si se forma algún cristal durxante la transferencia, caliente el recipiente en un baño de agua hirviendo hasta que se disuelvan. Si persisten los cristales, agregue nuevamente una pequeña cantidad de agua y caliente un poco más. Es muy importante que no haya ni un solo cristal en esta disolución antes del siguiente paso.
- Tapar el recipiente que contiene la disolución con papel film plástico e introdúzcalo en el refrigerador evitando golpear o manipular bruscamente el recipiente.
Experimentos de hielo caliente
La disolución fría así obtenida es una disolución sobresaturada de acetato de sodio que cristalizará rápidamente luego de cualquier perturbación formando un bloque caliente de cristales que se asemeja al hielo.
- Puedes experimentar con esta disolución de distintas maneras. Prueba agregando pequeños cristales en la superficie y verás cómo estos crecen en todas las direcciones formando hermosas agujas.
- Puedes también transferir una pequeña cantidad de disolución a una cápsula de Petri y otro recipiente de vidrio llano y sembrar cristales en dos extremos para ver cuáles crecen más rápidamente.
- Finalmente, muchas personas disfrutan vertiendo lentamente la disolución sobre un pequeño puñado de cristales en alguna superficie. A medida que cae la disolución, esta va cristalizando formando una estalagmita vertical de acetato de sodio.
Explicación del experimento del hielo caliente
La rápida cristalización del acetato de sodio se debe a que la disolución fría preparada es una disolución sobresaturada de la sal. Esto quiere decir que contiene más acetato de sodio disuelto del que el agua es capaz de disolver a dicha temperatura. Esto quiere decir que la disolución se encuentra en un estado metaestable que puede precipitar fácilmente por medio de cualquier perturbación que genere la formación de los primeros cristales, o por la adición de algunos cristales que sirvan de núcleos para la formación de nuevos cristales.
Esta perturbación puede consistir en sembrar un pequeño cristal en la superficie, tocar la disolución con el dedo o rayar la superficie del recipiente con un implemento metálico. A veces, el simple hecho de dar un golpe al recipiente es suficiente para desencadenar la cristalización
El proceso de cristalización se extenderá rápidamente a través de toda la disolución. El calor proviene del hecho de que la reacción química de cristalización es exotérmica, es decir, libera calor.
Medidas de seguridad
Afortunadamente, ninguno de los reactivos químicos utilizados en este experimento son tóxicos o peligrosos de ninguna manera. El acetato de sodio tampoco es un compuesto peligroso. De hecho, se utiliza como aditivo en la industria alimenticia.
Sin embargo, el experimento requiere calentar una disolución hasta ebullición y manipular dicha disolución caliente, lo cual representa un riesgo de quemadura considerable. No se debe llevar a cabo este experimento sin la supervisión de un adulto, y sin emplear guantes térmicos para proteger las manos del calor.
Referencias
Amoquimicos. (s. f.). Soda cáustica: qué es, características y precauciones. amoquimicos.com. https://www.amoquimicos.com/caracteristicas-de-la-soda-caustica
Chang, R., Manzo, Á. R., López, P. S., & Herranz, Z. R. (2020). Química (10.a ed.). McGraw-Hill Education.
ExperCiencias. (2017, 7 febrero). Hielo caliente instantáneo. YouTube. https://www.youtube.com/watch?v=ujuwKEZevfY
Laboratorium Discounter. (2021). Acetato sódico. laboratoriumdiscounter.nl. https://www.laboratoriumdiscounter.nl/es/quimicos/a-z/n/acetato-sodico/
Redacción CuídatePlus. (2020, 27 agosto). Bicarbonato. CuidatePlus. https://cuidateplus.marca.com/alimentacion/diccionario/bicarbonato.html
Seara, B. (2017, 7 febrero). Hielo Caliente Instantáneo – experimentos sorprendentes. experCiencia. https://www.experciencia.com/hielo-caliente/



