Tabla de Contenidos
Una reacción de hidrólisis es cualquier reacción química en la que una sustancia se descompone en dos sustancias más simples al reaccionar con agua. De hecho, la palabra hidrólisis está compuesta por hidro-, que significa agua, y –lisis que significa ruptura, así que hidrólisis significa literalmente “ruptura por la acción del agua”.
Una reacción de hidrólisis se puede representar de forma general por medio de la siguiente ecuación química:

En esta ecuación, AB puede representar a cualquier compuesto, tanto iónico como molecular. Como se puede observar, tras la reacción con el agua, el compuesto AB se rompe y cada una de las dos partes (A y B) terminan unidas a una de dos partes de la molécula de agua. En este caso, A termina unida con el grupo OH, mientras que B termina unida con el otro hidrógeno.
Se le considera reacción de hidrólisis a cualquier reacción que se pueda representar como la presentada anteriormente. Sin embargo, también existen otras reacciones de hidrólisis en las que el agua rompe a la otra molécula, uniéndose solo a una de las dos mitades.
Las reacciones de hidrólisis son comunes en química orgánica, en bioquímica y también en química inorgánica. A continuación se presentan reacciones de hidrólisis representativas en estas ramas de la química, junto con ejemplos específicos de cada una.
Reacciones de hidrólisis en química inorgánica
Muchos compuestos inorgánicos reaccionan con el agua de manera similar a la reacción anterior. Algunos ejemplos de reacciones de hidrólisis inorgánica son:
Hidrólisis de ácidos
Al disolver un ácido en agua, este reacciona con ella para formar la base conjugada del ácido e iones hidronio, como se muestra a continuación. Dependiendo de si se trata de un ácido fuerte o débil, esta reacción puede ser reversible o no.
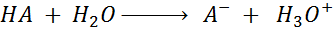
En este ejemplo en particular, una de las mitades del ácido no queda unida a una parte del agua como en la reacción de hidrólisis general; sin embargo, es incuestionable que el agua está rompiendo la molécula de ácido en dos, por lo que se puede considerar como una hidrólisis.
Ejemplos
- La hidrólisis o disociación ácida del ácido clorhídrico
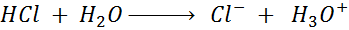
- La hidrólisis o disociación ácida del ácido acético
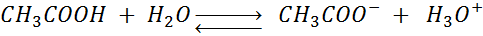
Hidrólisis de sales ácidas
Las sales inorgánicas formadas por la reacción de un ácido fuerte con una base débil son ejemplos de sales ácidas. Estas, al disolverse en agua, reaccionan disociándose por medio de una reacción de hidrólisis.
Ejemplo
- La hidrólisis del cloruro de amonio es un ejemplo de la hidrólisis de una sal ácida.
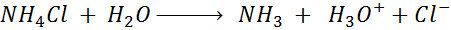
Hidrólisis de sales básicas
Aquellas sales formadas por la reacción entre un ácido débil y una base fuerte son ejemplos de sales básicas. Estas también se hidrolizan en agua para producir una solución alcalina.
Ejemplos
- La hidrólisis del acetato de sodio.
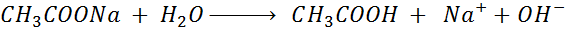
- La hidrólisis del sulfuro de potasio
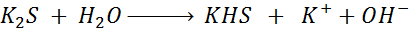
Reacciones de hidrólisis en química orgánica
Existen varios tipos de reacciones en la química orgánica que se consideran reacciones de hidrólisis. En efecto, las reacciones de hidrólisis son las reacciones inversas u opuestas a los distintos tipos de reacciones de condensación, como se muestra a continuación.
Reacciones de hidrólisis de los derivados de ácidos carboxílicos
Muchos derivados de los ácidos carboxílicos como los ésteres, las amidas, los haluros de ácido y los anhídridos pueden sufrir reacciones de hidrólisis. En todos estos casos, uno de los productos de la reacción es un ácido que contiene el grupo -OH del agua, mientras que la otra mitad de la molécula siempre se une al hidrógeno.
Además de estos casos, los éteres también pueden sufrir reacciones de hidrólisis para dar dos moléculas de alcohol. La hidrólisis de los nitrilos también lleva a la obtención de un ácido carboxílico y existen muchas otras reacciones orgánicas que se clasifican como reacciones de hidrólisis.
A continuación se presentan algunos ejemplos típicos de esta clase de reacciones.
Ejemplos de reacciones de hidrólisis orgánica
- La hidrólisis del acetato de etilo da como productos ácido acético y etanol.
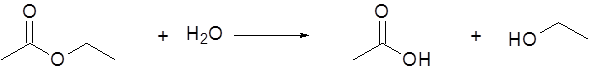
- La hidrólisis de la N-etilacetamida da como productos ácido acético y etanamina.

- El anhídrido propiónico se hidroliza para dar como productos dos moléculas de ácido propiónico.
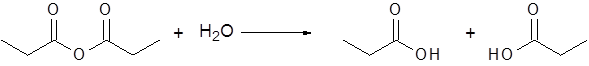
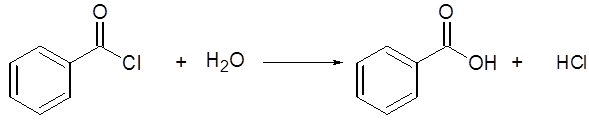
- La hidrólisis del cloruro de benzoilo da como productos ácido benzoico y ácido clorhídrico.
Reacciones bioquímicas de hidrólisis (hidrólisis enzimática)
Las reacciones bioquímicas son, por su puesto, reacciones orgánicas, por lo que las reacciones bioquímicas de hidrólisis son, en realidad, las mismas reacciones que acabamos de mencionar. Sin embargo, la hidrólisis es particularmente importante en el caso de las moléculas de importancia biológica por el simple hecho de que todas estas reacciones ocurren en medios acuosos como el citosol o en el plasma sanguíneo. Son verdaderamente incontables los ejemplos de reacciones de hidrólisis de importancia biológica.
Una de las principales diferencias entre las reacciones de hidrólisis bioquímicas y las reacciones de hidrólisis orgánicas comunes es que las bioquímicas son catalizadas, en su mayoría, por diferentes clases de enzimas; este no es el caso con las reacciones de hidrólisis orgánicas.
Ejemplos de hidrólisis bioquímica
- Para empezar, la reacción que proporciona la energía para la inmensa mayoría de las demás reacciones bioquímicas consiste en la hidrólisis de la molécula de adenosin trifosfato o ATP.
- Por otro lado, la degradación de las proteínas a aminoácidos libres consiste en la ruptura de enlaces peptídicos, lo cual no es más que una reacción de hidrólisis de una amida.
- Otros ejemplos son la hidrólisis de los polisacáridos para dar oligosacáridos cortos o monosacáridos libres, la ruptura de las moléculas de ADN, el splicing del ARN, la degradación de triglicéridos y muchos, muchos más.
Referencias
Carey, F., & Giuliano, R. (2014). Química orgánica (9.a ed.). Madrid, España: McGraw-Hill Interamericana de España S.L.
Fernández. G. (s.f.). Hidrólisis ácida de ésteres. Recuperado de https://www.quimicaorganica.org/esteres/448-hidrolisis-acida-de-esteres.html
Hidrólisis (29 de mayo de 2017). Recuperado de https://todoenpolimeros.com/2017/05/29/hidrolisis/
Smith, M. B., & March, J. (2001a). March’s Advanced Organic Chemistry: Reactions, Mechanisms, and Structure, 5th Edition (5th ed.). Hoboken, New Jersey: Wiley-Interscience.



