Tabla de Contenidos
Los gases nobles conforman el grupo 18 de elementos de la tabla periódica (antiguamente grupo VIII-A). Estos elementos se caracterizan por tener una configuración electrónica de capa llena en la que el último nivel de energía tiene sus orbitales s y p completamente llenos. Esta configuración electrónica es particularmente estable, razón por la cual estos elementos no tienen la necesidad de formar enlaces químicos para compartir electrones buscando más estabilidad. De hecho, la mayor parte de las reacciones químicas que sufren los demás elementos de la tabla periódica lo hacen para lograr rodearse de los mismos 8 electrones que rodean a los gases nobles. A esto se le conoce como la regla del octeto.
Por el mismo hecho de ser tan estables, los elementos del grupo 18 también son extremadamente inertes y no se combinan prácticamente con ningún otro elemento. Además, estos elementos ni siquiera tienen tendencia a enlazarse unos con otros, y las únicas interacciones que se dan entre dos átomos son las débiles fuerzas de dispersión de London. Por esta razón, estos elementos poseen puntos de ebullición muy bajos y se encuentran generalmente en estado gaseoso en condiciones normales de temperatura y presión. Ambas características fisicoquímicas les han ganado a estos elementos el nombre de gases nobles.
En resumen, lo que hace que los gases nobles sean gases nobles es que se encuentren en estado gaseoso y que sean químicamente inertes. Este es un punto importante al momento de determinar cuál es el gas noble más pesado.
¿Qué significa ser el gas noble más pesado?
Definamos en primer lugar a qué nos referimos por “el gas noble más pesado.” Este calificativo puede tener en realidad una de dos interpretaciones: por un lado, puede referirse a el elemento gaseoso que tenga el mayor peso atómico. Por otro, podríamos referirnos al gas más denso.
A pesar de que la densidad es proporcional a la masa molar de un gas y de que la masa molar de los gases aumenta a medida que bajamos en un grupo de la tabla periódica, la respuesta a la pregunta de cuál es el gas más pesado no es tan simple como bajar en la lista hasta el último elemento del grupo.
De hecho, hay dos candidatos para el gas noble más pesado y ninguno de los dos es el último elemento del grupo.
El oganesón no es el gas noble más pesado
Como mencionamos hace un instante, en contra de la intuición inicial, el gas noble más pesado no es el último miembro del grupo, es decir, el oganesón, símbolo químico Og. Esto se debe a varias razones. Para empezar, el oganesón es un elemento transactínido sintético, lo cual significa que este elemento no existe en la naturaleza, sino que fue sintetizado en un acelerador de partículas por medio de la fusión nuclear.
El problema con el oganesón, y la principal razón por la que no podemos darle el título del gas noble más pesado, es que tiene un tiempo de vida muy corto; menos de 1 ms. Además, los elementos sintéticos se producen en cantidades extremadamente pequeñas. Por ambas razones, es casi imposible acumular suficientes átomos de oganesón durante un tiempo suficiente como para medir sus propiedades fisicoquímicas. En consecuencia, no se sabe nada a ciencia cierta sobre el estado físico de este elemento a temperatura y presión normal.
De hecho, se calcula que, si llegara a durar lo suficiente, este elemento sería un sólido a temperatura ambiente. Ya de por sí esto lo descalifica como el “gas noble” más pesado, a pesar de tratarse del elemento más pesado conocido por el hombre.
Por otro lado, también se han llevado a cabo múltiples cálculos teóricos sobre la estructura electrónica que tendría este elemento y los resultados son realmente inesperados. Se sostiene la hipótesis de que la gran carga nuclear aceleraría a los electrones casi a la velocidad de la luz, lo que hace que se comporten de manera muy diferente a los demás elementos conocidos. La consecuencia más clara de esto es que en realidad ni siquiera sabemos si tendría las mismas características inertes de los demás miembros del grupo.
Bajo ciertas condiciones, el xenón puede llevarse el trofeo
Dado que los gases, en especial los gases nobles, se comportan como gases ideales en condiciones normales de temperatura y presión, se puede obtener fácilmente una relación entre la densidad y la masa molar de un gas. Esta relación viene dada por:
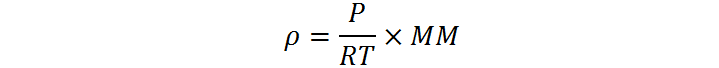
Donde ρ es la densidad del gas en g/L, P es la presión en atmósferas, T es la temperatura absoluta, R es la constante de los gases ideales y MM es la masa molar del gas. Como se puede ver, la densidad es directamente proporcional a la masa molar. Si consideramos que todos los gases nobles se encuentran en forma de elementos monoatómicos, el elemento más denso debería ser el radón.
Sin embargo, bajo ciertas condiciones muy especiales (aplicando descargas eléctricas sobre un jet supersónico de xenón gaseoso), es posible convertir el xenón en dímeros ionizados o en iones moléculares diatómicos de fórmula Xe2+. Este nuevo gas tendría una masa molar de 263 g/mol, la cual es mayor que la masa molar del radón que es 222 g/mol. Al tener una masa molar mayor, esta forma gaseosa de Xe sería más densa que el radón gaseoso, robándole así la corona.
Sin embargo, esto sería considerablemente especulativo, ya que las condiciones en las que se forman los dímeros son difíciles de mantener, por lo cual las especies moleculares duran muy poco tiempo.
El gas noble más pesado es el radón (Rn)
Dados los argumentos anteriores, concluimos que el gas noble más pesado es el radón. Este elemento es un gas inerte, incoloro e inodoro que además es radiactivo.
De todos los elementos del grupo 18, el radón es el que tiene el peso atómico más alto (222 u) y, fuera de la excepción discutible del Xe2, es también el gas más denso de entre los gases nobles, con una densidad de 9,074 g/L a una temperatura de 25 °C y una presión de 1 atm.
Referencias
Dubé, P. (1991, 1 diciembre). Supersonic cooling of rare-gas excimers excited in dc discharges. Optica Publishing Group. https://www.osapublishing.org/ol/abstract.cfm?uri=ol-16-23-1887
Jerabek, P. (2018, 31 enero). Electron and Nucleon Localization Functions of Oganesson: Approaching the Thomas-Fermi Limit. Physical Review Letters 120, 053001. https://journals.aps.org/prl/abstract/10.1103/PhysRevLett.120.053001
Lomaev, M. I., Tarasenko, V., & Schitz, D. (2006, junio). A high-power xenon dimer excilamp. Technical Physics Letters 32(6):495–497. https://www.researchgate.net/publication/243533559_A_high-power_xenon_dimer_excilamp
National Institute of Standards and Technology. (2021). Xenon dimer. NIST. https://webbook.nist.gov/cgi/inchi/InChI%3D1S/Xe2/c1-2
Oganessian, Y. T., & Rykaczewski, K. P. (2015). A beachhead on the island of stability. Physics Today 68, 8, 32. https://physicstoday.scitation.org/doi/10.1063/PT.3.2880



