Tabla de Contenidos
La regla del octeto es una teoría en la que se establece que existe una tendencia tendencia de los elementos a completar su capa de valencia con un total de 8 electrones (octeto). Esta regla, desarrollada por el fisicoquímico estadounidense Gilbert N. Lewis en 1916, permite proponer aproximaciones acerca de la estructura de ciertos compuestos.
Con esta práctica, mediante un análisis de las posibles reacciones y combinaciones, se puede predecir la estructura de las moléculas unidas mediante enlaces covalentes. De este modo, los átomos buscan tener ocho electrones en su capa de valencia, compartiendo, ganando o perdiendo electrones. La regla también es muy funcional y rápida a la hora de predecir la estructura molecular de un compuesto.
La regla del octeto
La regla del octeto hace referencia a la ganancia o pérdida de electrones que tienen los átomos para conseguir en su capa de valencia la configuración más cercana a la de gas noble. También determina si se ganará o perderá un electrón a través de las reacciones químicas, y mide la reactividad de los átomos basándose en su configuración electrónica específica.
Aunque esta regla generalmente se aplica a metales y no metales, no puede describir completamente los compuestos de los elementos de transición en los que están involucrados los orbitales d o f.
Solo los electrones de los elementos que se encuentran en los grupos principales de la tabla periódica siguen la regla del octeto, correspondiendo a la configuración electrónica ns2p6. Los átomos que consiguen ocupar todos los electrones de la capa de valencia con ocho electrones tienen una mayor estabilidad y emiten menos energía.
Según lo mencionado anteriormente, esta regla no predeciría con precisión las configuraciones electrónicas de todas las moléculas y compuestos. En consecuencia, debe usarse con cuidado para predecir las configuraciones electrónicas, ya que tiene muchas excepciones.
Regla del octeto y enlace covalente
Las moléculas se forman cuando los átomos se unen mediante enlaces covalentes. Cada enlace permite a los átomos conseguir o perder electrones adicionales para así acercarse a la configuración de electrónica que constituiría 8 electrones en su capa de valencia.
Solo los elementos no metálicos de los grupos 4, 5, 6 y 7 forman enlaces covalentes. Los metales forman otro tipo de enlaces y los gases nobles no reaccionan por tener su capa de valencia completa.
- Grupo 4, el carbono: se encuentra en el cuarto grupo y tiene cuatro electrones de valencia. Necesita cuatro electrones más para conseguir el octeto. Lo mismo sucede con el resto de los elementos de su grupo.
- Grupo 5, el nitrógeno: se encuentra en el quinto grupo y necesita tres electrones para conformar el octeto. Como en el caso anterior, sucede lo mismo con el resto de los elementos de su grupo.
- Grupo 6, el azufre: siguiendo las mismas pautas que los dos anteriores, necesitaría dos electrones para llegar a 8.
- Grupo 7, el flúor: necesitaría un electrón para llegar a 8 electrones.
El grupo 8 está constituido por los gases nobles. Los gases nobles no son reactivos, ya que tienen completa su capa de valencia. Así, por ejemplo, el neón tiene una configuración electrónica 1s2 2s22p6. Es decir, su capa de valencia externa está completa, tiene 8 electrones y no puede incorporar más. El resto de los gases nobles tienen la misma configuración electrónica en su capa de valencia, incluso cuando tienen distintos electrones en sus capas más internas.
Elementos deficientes en electrones
El hidrógeno, el berilio y el boro tienen muy pocos electrones para formar un octeto. El hidrógeno es un elemento que difiere bastante en su comportamiento respecto a otros elementos; se trata del elemento más abundante del universo. Constituye una excepción de la regla del octeto. Tiene solo un electrón, que tiende a formar enlaces. Como el hidrógeno suele formar enlaces para estabilizarse, no necesita los siete electrones para completar su capa de valencia; lo que hace es perder el único electrón que posee.
El berilio solo tiene dos electrones en su capa de valencia, y el boro tres, y actúan de manea similar al hidrógeno en cuanto a la forma de organizar su capa de valencia.
El neón, a pesar de ser un gas noble, tiene dos electrones, necesitaría seis electrones para conseguir llenar su capa de valencia, algo que energéticamente es casi imposible. Lo que sucede es que suele compartir electrones para estabilizar su capa de valencia más externa, del mismo modo que lo hacen los tres elementos anteriormente mencionados.
Elementos del grupo d
Los elementos en períodos mayores que el período 3 en la tabla periódica tienen un orbital d disponible con el mismo número cuántico de energía. Los átomos en estos períodos pueden seguir la regla del octeto, pero existen condiciones en las que pueden expandir sus capas de valencia para acomodar más de ocho electrones. El azufre y el fósforo son ejemplos comunes de este comportamiento. El azufre puede seguir la regla del octeto, como en la molécula SF2, difluoruro de azufre. Cada átomo está rodeado por ocho electrones. Es posible excitar el átomo de azufre lo suficiente como para empujar los átomos de valencia hacia el orbital d para permitir moléculas como SF4 (tetrafluoruro de azufre) y SF6 (hexafluoruro de azufre). El átomo de azufre en SF4 tiene 10 electrones de valencia, y 12 electrones de valencia en SF6.
Radicales libres
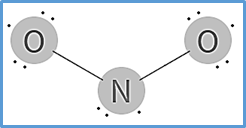
Los radicales libres contienen al menos un electrón desapareado en su capa de valencia. En general, las moléculas con un número impar de electrones tienden a ser radicales libres. El óxido de nitrógeno (IV) (NO2) es un ejemplo conocido de radical libre. Se puede ver el electrón solitario en el átomo de nitrógeno en la estructura de Lewis.
Referencias
Martínez, M. Excepciones de la regla del octeto. UnProfesor. Recuperado el 22 de febrero de 2022 de https://www.unprofesor.com/quimica/excepciones-de-la-regla-del-octeto-1066.html
Octet Rule – Easy Hard Science. (2022). Recuperado el 22 de febrero del 2022 de https://learnwithdrscott.com/octet-rule/
The Octet Rule. (2015). Chemistry LibreTexts. Recuperado el 22 de febrero de https://chem.libretexts.org/Bookshelves/Physical_and_Theoretical_Chemistry_Textbook_Maps/Supplemental_Modules_(Physical_and_Theoretical_Chemistry)/Electronic_Structure_of_Atoms_and_Molecules/Electronic_Configurations/The_Octet_Rule



