Tabla de Contenidos
El concepto tradicional de pH
Tradicionalmente, el pH se define como el negativo del logaritmo de base 10 de la actividad (léase concentración, por simplicidad) de iones hidronio en una solución acuosa, es decir,
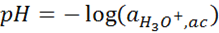
donde la actividad es una forma corregida de la concentración molar. Detalles aparte, el pH permite representar, en una misma escala, valores de concentración de este ion que pueden llegar a diferir en hasta 14 órdenes de magnitud.
En química y biología, la escala de pH se utiliza para medir el nivel de acidez o basicidad de una solución acuosa en relación con el agua pura, la cual se considera neutra. El punto de referencia de la escala (el punto neutro) está definido en términos del equilibrio de autoprotólisis del agua, que viene dado por la siguiente ecuación química:

En una solución neutra, como en el caso del agua pura, existe una concentración equivalente de iones hidróxido (OH–) e hidronio (H3O+), cuyo valor es de 10-7 M, correspondiente a un pH de 7.
Como se puede ver, todo lo relacionado con el pH, desde su definición en términos de la concentración del ion hidronio (que solo está presente en el agua), hasta la definición del punto medio de la escala o punto de neutralidad, está establecido exclusivamente para el agua o para soluciones acuosas de diferentes solutos.
El pH del aceite vegetal
Lo expuesto en los párrafos anteriores quiere decir que, si quisiéramos hablar del pH del aceite vegetal, forzosamente nos tendríamos que referir al pH de una solución de aceite vegetal en agua. Sin embargo, el aceite vegetal es insoluble en el agua, por lo que no se pueden preparar soluciones acuosas de dicho soluto. Lo mismo se puede decir de los aceites minerales y de cualquier otra sustancia que no sea hidrosoluble. Como consecuencia, el aceite vegetal no tiene pH o, mejor dicho, no tiene sentido hablar acerca del pH del aceite vegetal (o de cualquier otro aceite) ya que este concepto, visto de la manera tradicional, no existe en ausencia de agua.
Se podría argumentar que ningún soluto es absolutamente insoluble en un solvente, y que, aunque sea una ínfima cantidad de aceite podría, eventualmente, disolverse en agua. Si ese fuera el caso, la concentración sería tan baja que sería casi imposible distinguirlo del pH neutro de 7.
pH, índice de acidez y ácidos grasos libres en el aceite vegetal
Resulta conveniente hacer una pequeña aclaratoria. La razón por la que muchas personas se preguntan cuál es el pH del aceite vegetal, a pesar de que esto no tiene sentido químico, es porque los aceites comestibles, tales como los aceites vegetales, están formados principalmente por ésteres de ácidos grasos llamados triglicéridos y por ácidos grasos libres (es decir, que no están esterificados).
Uno de los parámetros de calidad de un aceite comestible es su índice de acidez, el cual está relacionado con la proporción de ácidos grasos libres que contiene. El índice de acidez se refiere a la cantidad de KOH en miligramos que se requiere para neutralizar todos los ácidos grasos libres presentes en un aceite. Mientras mayor es el índice de acidez, de peor calidad es el aceite.
Debido a la relación obvia entre el pH y la acidez de las soluciones acuosas, es natural que la mayoría de las personas busquen una relación similar entre el “índice de acidez” del aceite vegetal y el pH, a pesar de que no tienen absolutamente nada que ver el uno con el otro.
El “pH” del aceite en otras escalas de acidez
El hecho de que a una sustancia como el aceite vegetal no se le pueda asignar un nivel de acidez (léase pH) en solución acuosa no significa que el aceite vegetal carezca de acidez. Simplemente significa que la escala de pH no es adecuada para medir dicha acidez, ni mucho menos para poder comparar la acidez del aceite vegetal frente a la de otras sustancias químicas.
En vista de esto, se han establecido escalas de acidez equivalentes al pH pero para otros solventes como el dimetilsulfóxido o el acetonitrilo, por nombrar solo dos. En dichos casos, se han planteado equilibrios de autoprotólisis similares a los del agua y escalas de acidez similares a la del pH, pero en términos de la concentración de los iones de dichos solventes en lugar del ion hidronio.
En estos casos, en lugar de una escala que va de 0 a 14 (que es el valor del pKW), la escala de acidez se establece en base al pKa del solvente, por lo que cada solvente tiene asociada su propia escala. En estos casos, es posible encontrar un solvente para el que se haya establecido una escala de acidez similar, y que sea capaz de disolver al aceite vegetal. Si bien no se llamaría pH ni tampoco se podría comparar con los valores de la escala de pH en agua, se tendría un valor para el nivel de acidez del aceite vegetal.
Una escala de pH universal
Preguntas como cuál es el pH del aceite pueden parecer básicas, pero los químicos y fisicoquímicos se las han estado haciendo desde que se definió qué es un ácido y qué es una base en 1887; y lo que es más, el debate aún continúa. Apenas en 2010 se publicó en una revista científica reconocida la idea de una escala unificada de pH que fuera aplicable no solo a soluciones acuosas y a soluciones en otros solventes, sino incluso al estado gaseoso y al estado sólido, sistemas en los que el pH tradicional nada tiene que hacer.
Así que la próxima vez que alguien te pregunte cuál es el pH del aceite queriendo parecer inteligente y hacerte caer en una pequeña trampa, pregúntale a cuál de las escalas de pH se refiere.
Referencias
- Himmel, D., Goll, S. K., Leito, I., & Krossing, I. (2010). A Unified pH Scale for All Phases. Angewandte Chemie International Edition, 49(38), 6885–6888. https://onlinelibrary.wiley.com/doi/epdf/10.1002/anie.201000252
- Rodríguez, A., Ruiz L., Santoyo, S., Miranda, V. (2016). Determinación del índice de acidez y acidez total de cinco mayonesas. Recuperado de http://www.fcb.uanl.mx/IDCyTA/files/volume1/2/10/146.pdf
- Kardash, E., Tur’yan (2005). Acid Value Determination in Vegetable Oils by Indirect Titration in Aqueous-alcohol Media. Croatica Chemica Acta 78(1):99-103 Recuperado de https://www.researchgate.net/publication/279556165_Acid_Value_Determination_in_Vegetable_Oils_by_Indirect_Titration_in_Aqueous-alcohol_Media Kuselman (1998). pH-Metric Determination of the Acid Value of Vegetable Oils without Titration. JOURNAL OF AOAC INTERNATIONAL VOL. 81, No. 4, 1998.



