Tabla de Contenidos
El número de Avogadro o la constante de Avogadro (NA), representa la cantidad de átomos de carbono que hay en exactamente 12 gramos de una muestra completamente pura del isótopo carbono-12. Al mismo tiempo, representa la cantidad de unidades contenidas en 1 mol de cualquier sustancia y tiene un valor de 6,022 .1023 mol-1.
En pocas palabras, comprender el número de Avogadro y saber utilizarlo para llevar a cabo cálculos en química, es la manera más directa de comprender el concepto de mol, el cual es central para esta rama de la ciencia. Es por esto que, en el presente artículo, mostraremos, paso a paso, cómo resolver dos problemas típicos de química que involucran el uso del número de Avogadro.
Comenzaremos con un problema sencillo para explicar las bases necesarias, y luego pasaremos a un problema más complejo que involucra varios cálculos separados.
Problema 1
Enunciado
Determine el número de moléculas de agua que hay en una gota de este líquido, sabiendo que la misma pesa 0,500 g. Datos: PAH = 1 uma, PAO = 16 uma.
Solución
Como siempre que vayamos a resolver cualquier problema, debemos comenzar analizando el enunciado y extrayendo los datos relevantes. En este caso, solo tenemos como información el hecho de que se trata de agua, la masa de la gota y los pesos atómicos del hidrógeno y el oxígeno.
magua = 0,500g
La fórmula molecular del agua es H2O, así que su peso molecular es:
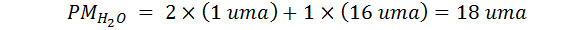
La incógnita es el número de moléculas de agua, el cual se representa con la letra N mayúscula. De esta manera se diferencia del número de moles que se representa con la n minúscula. Es decir:
Nagua = ?
Para resolver este problema, así como la mayoría de problemas que involucran la constante de Avogadro, se utiliza la relación entre en número de partículas y el número de moles que es la siguiente:
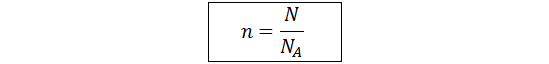
En este caso en particular, estamos interesados en hallar N, así que debemos reordenar esta ecuación. Además, siempre es aconsejable identificar tanto los números de moles que estamos calculando como los números de partículas con la sustancia, átomo o ion particular del que se trate, para evitar confusiones cuando se debe calcular moles o números de partículas de varias sustancias en el mismo problema (lo cual haremos en el siguiente problema).
Así que, la fórmula que utilizaremos para hallar el número de partículas de agua será:
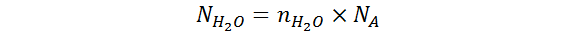
Como se puede ver, para calcular la incógnita que queremos nos hace falta el número de moles de agua. Afortunadamente, estos se pueden calcular a partir de la masa de agua utilizando la siguiente ecuación:
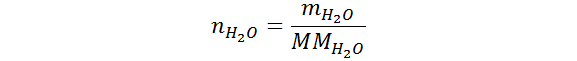
Como tenemos el peso molecular del agua (PM) el cual es numéricamente igual a su masa molar (pero con unidades diferentes), entonces ya tenemos todo lo necesario para resolver el problema. Podemos calcular los moles primero y sustituirlos luego en la fórmula de número de partículas, o, podemos sustituir la expresión de los moles en la ecuación anterior y llevar a cabo un solo cálculo.
En este caso, haremos lo segundo:
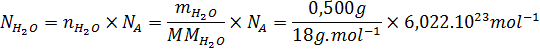
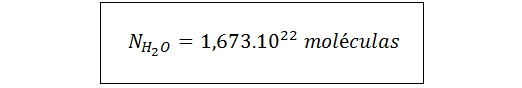
Así que, en una gota de 0,500 g de agua hay 1,673.1022 moléculas de agua. Nótese que el número de moléculas, N, es un número puro. Es decir, no tiene unidades. Nosotros le debemos colocar las unidades al final según corresponda a lo que estamos calculando, en este caso, moléculas de agua.
Problema 2
Enunciado
Determine el número de iones sulfato y el número de átomos de oxígeno totales presentes en una muestra de 10 mg sulfato de aluminio hidratado cuya fórmula es Al2(SO4)3.18H2O. La masa molar de la sal es 666,42 g.mol-1.
Solución
Nuevamente deseamos determinar un número de partículas, pero en este caso no se trata del compuesto completo (como en el caso del agua) sino de algunas partes de la sustancia. Se debe comenzar transformando la masa a gramos ya que la masa molar la tenemos en gramos sobre mol:
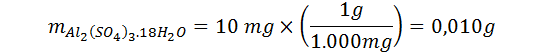
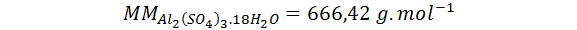
Con estos datos podemos calcular el número de moléculas o unidades fórmula de la sal que están presentes en la muestra de la misma forma que hicimos en el problema anterior. Pero esto no es lo que queremos determinar.
Sin embargo, a partir de la fórmula molecular podemos establecer las relaciones estequiométricas sencillas que nos permitirán calcular lo que necesitamos:
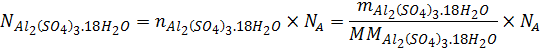
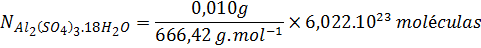
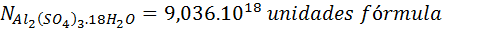
Ahora, podemos ver en la fórmula que hay 3 iones sulfato por cada unidad fórmula de la sal. Así que podemos convertir unidades de sal a iones sulfato simplemente multiplicando por esta relación estequiométrica:
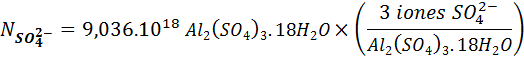
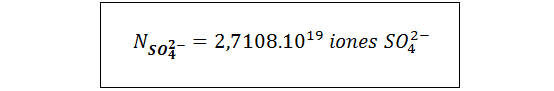
Para en número de átomos de oxígeno, necesitamos sumar todos los oxígenos presentes en los iones sulfato y los presentes en las moléculas de agua:
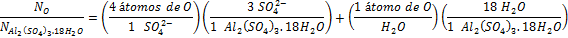
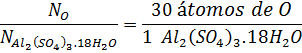
Con esta relación, calculamos el número de oxígenos en la muestra a partir del número de unidades fórmula como hicimos con los iones sulfato:
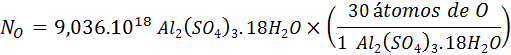
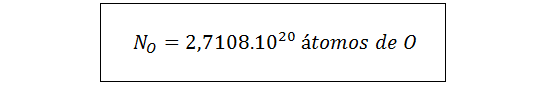
Referencias
Avogadro’s Number. (2021, June 25). Recuperado de https://chem.libretexts.org/@go/page/53765
Avogadro’s Number and the Mole. (2021, January 3). Recuperado de https://bio.libretexts.org/@go/page/8788
Brown, T. (2021). Química: La Ciencia Central (11ra ed.). Londres, Inglaterra: Pearson Education.
Chang, R., Manzo, Á. R., López, P. S., & Herranz, Z. R. (2020). Química (10ma ed.). New York City, NY: MCGRAW-HILL.
The Mole and Avogadro’s Constant. (2020, August 15). Recuperado de https://chem.libretexts.org/@go/page/1338



