Tabla de Contenidos
Esta es una pregunta muy frecuente que se le suele hacer a los estudiantes de química de distintos niveles, ya que resalta algunas de las características más importantes de cata tipo de proceso y requiere el uso del juicio y pensamiento crítico para decidir de qué tipo de cambio se trata.
Para encontrar la respuesta, debemos tener claro qué son los procesos químicos y físicos, cómo los reconocemos y qué es, exactamente, lo que sucede cuando disolvemos sal en agua.
Cambios físicos versus cambios químicos
Los cambios físicos se definen como aquellos que pueden cambiar el aspecto o el estado de agregación de una sustancia, más no cambian su naturaleza química. Esto quiere decir que son aquellos cambios en los que las sustancias pasan de una fase a otra, como se sólido a líquido o de líquido a gas, pero su composición sigue siendo la misma.
Por ejemplo, cuando se derrite el hielo, el cual está formado por moléculas de agua (H2O), este se convierte en agua líquida, la cual, obviamente, también está formada por las mismas moléculas. Las propiedades físicas y el aspecto cambiaron radicalmente, pero siguen teniendo la misma composición.
En este caso, no ocurrió ninguna reacción química que cambiara la naturaleza de las moléculas que formaban parte del hielo.
Por otro lado, las transformaciones químicas se caracterizan por la ocurrencia de una reacción química que cambia la estructura o la naturaleza química de las sustancias. Además de un cambio del aspecto físico, se puede observar la apariencia de sustancias químicas diferentes a las originales.
Por ejemplo, en la electrólisis del agua, las moléculas se rompen para formar hidrógeno y oxígeno molecular, por lo que se trata de un cambio químico.
¿Cómo distinguir entre los dos?
Una clave para reconocer y distinguir los procesos físicos de los químicos es que los primeros se pueden representar por medio de ecuaciones químicas en las que los reactivos y los productos son sustancias químicas diferentes.
Por otro lado, en vista de que los procesos físicos no cambian la naturaleza de las sustancias, entonces estas se pueden recuperar inalteradas por medio de otros procesos físicos como la evaporación, la destilación, la solidificación, etc.
Sin embargo, se debe tener cuidado en este análisis, ya que es posible que procesos como la evaporación lleven a la ocurrencia de un proceso químico inverso que regenere la sustancia química original. El punto es que algunos procesos son más difíciles de distinguir que otros, por lo que se hace necesario buscar evidencia adicional que apoye la hipótesis respectiva.
¿Qué sucede cuando disolvemos sal en agua?
La sal común de mesa o NaCl, es un compuesto iónico sólido a temperatura ambiente, que está formado por una red cristalina de iones sodio y cloruros. Cuando se disuelve en agua, este solvente separa a los iones y los encierra en una especie de jaula de moléculas de agua, formándose los iones solvatados. Este proceso se puede representar por medio de la siguiente ecuación química:
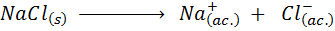
Un proceso similar sucede siempre que disolvemos cualquier electrolito fuerte en agua. A simple vista, lo único que vemos es que los cristales de sal (el NaCl sólido) se disuelven progresivamente hasta desaparecer. Sin embargo, hay mucha evidencia que sugiere que, de hecho, ocurrió el cambio químico representado por la ecuación anterior.
La principal evidencia está en el hecho de que el cloruro de sodio sólido no tiene la capacidad de conducir la electricidad, ya que los iones se encuentran atrapados en la estructura cristalina. Sin embargo, al disolverlos en agua, la solución resultante sí conduce la electricidad.
Para que esto ocurra, debe ser posible que los iones con cargas opuestas se muevan independientemente a los dos electrodos opuestos, lo cual solo sucederá si los iones sodio y cloruro están efectivamente separados. Si permanecieran unidos, como en el NaCl, las partículas se sentirían igualmente atraídas por ambos electrodos por lo que no se moverían, y al no moverse, no habría conducción de la electricidad.
En pocas palabras, durante la disolución del NaCl, se rompe el enlace iónico que mantiene unidas a las partículas del compuesto, y la ruptura de un enlace químico es la marca distintiva de un cambio químico.
El veredicto: ¿Por qué la disolución de sal en agua es un proceso químico?
En base a lo dicho hace un momento, está claro que los iones Na+(ac) y Cl–(ac) son especies químicas diferentes del NaCl(s). Por esta razón, el proceso de disolución implica un cambio de la naturaleza química de la sal, por lo que se clasifica como un proceso químico.
Visto de otro modo, los procesos de disociación son evidentemente procesos químicos y, en vista de que la disolución de sales en agua implica la disociación del compuesto en sus iones constituyentes, entonces son necesariamente procesos químicos.
¿Por qué algunos consideran la disolución de la sal como un proceso físico?
Todo parece bastante claro luego de analizarlo como hace un momento. Entonces, ¿por qué surge la duda? La razón es que, como hemos visto en otras ocasiones, no todo es blanco y negro. Resulta que también hay otros argumentos a favor de que el proceso sea netamente físico y no químico.
Para empezar, está el hecho de que ni el catión sodio ni en anión cloruro sufren ningún cambio en la estructura electrónica de su capa de valencia durante la disolución. Esto lo interpretan muchas personas como la ausencia de un cambio químico. A pesar de que es un punto importante, se debe recordar que el enlace iónico no involucra electrones compartidos entre los iones, así que romper este tipo de enlace no afecta la distribución electrónica de los iones.
Por otro lado, mucho también utilizan el argumento de que la sal se puede recuperar fácilmente al evaporar el agua, cosa que es completamente cierta. Sin embargo, que un proceso sea reversible no implica de ninguna forma que sea necesariamente físico. De hecho, muchísimos procesos químicos, incluidas las reacciones de disociación, son procesos reversibles. Por otro lado, no todos los procesos físicos son reversibles.
Algunas palabras finales sobre la discusión
En virtud de todos los argumentos a favor y en contra, la discusión sobre la naturaleza del proceso de disolución de las sales sigue, y es bueno que lo haga, pues pone a los estudiantes de química a pensar y a analizar la evidencia desde un punto de vista crítico.
El problema que causa tanta confusión es que muchas veces tendemos a pensar en los compuestos iónicos de la misma forma que lo hacemos de los compuestos covalentes, como si fueran moléculas discretas (de NaCl, por ejemplo), cuando en realidad no los son.
Hablar sobre la ruptura de un enlace iónico no es como hablar de la ruptura de un enlace covalente, a pesar de que ambos son enlaces químicos.
En el caso de los compuestos moleculares, el enlace covalente solo mantiene unidos entre sí a los átomos que forman cada molécula. Las fuerzas cohesivas que mantienen a las moléculas juntas en el estado sólido y líquido son las fuerzas intermoleculares. Estas son las interacciones que se rompen o se regeneran en los procesos físicos.
En cambio, en los compuestos iónicos, no existen ni fuerzas intramoleculares ni intermoleculares, ya que no hay moléculas. El enlace iónico representa la única fuerza cohesiva que mantiene unidos a todos los iones en la red cristalina, por lo que romper estas fuerzas al disolver una sal se parece mucho a lo que sucede cuando rompemos las fuerzas intermoleculares al derretir un sólido molecular o al evaporarlo (ambos procesos físicos).
Por lo tanto, estamos hablando de una zona gris. En últimas instancias, lo importante no es si este proceso es o no físico o químico ni quién gane la discusión. Lo importante aquí es que se genere la discusión y que los estudiantes aprendan a defender sus puntos de vista y a entender los puntos de vista de los demás.
Nota sobre otros procesos de disolución
Cabe resaltar que el hecho de que el proceso de disolución de las sales sea un proceso químico no implica necesariamente que todos los procesos de disolución también lo sean. Esto solo es cierto para electrolitos que se disocian en solución, ya que el proceso de disociación es un cambio químico.
En cambio, cuando disolvemos solutos moleculares que no se ionizan, como por ejemplo al disolver azúcar en agua, u octano en benceno, las moléculas del soluto no sufren la ruptura o formación de ningún enlace químico entre los átomos que las componen. Por esta razón, estos procesos de disolución sí son procesos físicos.
Referencias
Brown, T. (2021). Quimica: La Ciencia Central (11ava ed.). Londres, Inglaterra: Pearson Education.
Chang, R., Manzo, Á. R., López, P. S., & Herranz, Z. R. (2020). Química (10.a ed.). New York City, NY: MCGRAW-HILL.
Clasificación de la materia: Propiedades de la materia. Recuperado de https://www.clevelandmetroschools.org/
Las propiedades físicas y químicas. (2020, October 30). Recuperado de https://espanol.libretexts.org/@go/page/1795



