Tabla de Contenidos
En química, es común trabajar con diferentes unidades de concentración, y la moralidad y la normalidad son dos de las que se utilizan con más frecuencia. Por un lado, la molaridad es una unidad química de concentración que indica el número de moles de soluto que hay por cada litro de solución. Por otro lado, la normalidad también es una unidad de concentración química, pero expresada en términos del número de equivalentes de soluto por cada litro de solución.
A pesar de que pueda no parecerlo, la normalidad y la molaridad están muy relacionadas, ya que el número de moles y de equivalentes también lo están. Sin embargo, hay una serie de diferencias muy importantes que hacen que cada unidad sea más práctica o útil para diferentes aplicaciones. Por esta razón, en el presente artículo, se cubrirá la diferencia entre molaridad y normalidad, para qué sirve cada una de estas unidades de concentración, cómo se calculan, como se convierte de una unidad de concentración a la otra y en qué situaciones es más conveniente utilizar una o la otra.
Molaridad
Como se mencionó al principio, la molaridad es una unidad química de concentración en la que la cantidad de soluto se expresa en términos del número de moles y el volumen de la solución en litros. Es una de las unidades de concentración más utilizadas ya que permite conocer de manera muy fácil y rápida la cantidad de soluto presente en cualquier volumen de solución.
La molaridad se expresa en unidades de mol/L, lo cual se suele leer como “molar”. Así, una concentración de 0,5 mol/L se suele leer 0,5 molar.
Fórmulas para calcular la molaridad
La fórmula que define a la molaridad es:
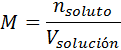
donde nsoluto representa el número de moles de soluto y Vsolución representa el volumen de la solución expresado en litros. Sin embargo, es muy común reemplazar el número de moles por su fórmula que viene dada por la masa dividida entre la masa molar del soluto para dar la siguiente fórmula:
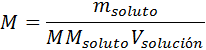
¿Cuándo conviene utilizar la molaridad?
La molaridad es una unidad de concentración de uso general, lo que significa que sirve prácticamente para cualquier situación en la que se trabaje con soluciones, dado que no haya cambios grandes de temperatura.
Esto último se debe a que la temperatura puede afectar el volumen de una solución, lo que hace que la molaridad, la cual depende de dicho volumen, también varíe con la temperatura. En estos casos, es preferible utilizar otra unidad de concentración que esté expresada en términos de masa o de cantidad de materia, tal como la molalidad o las fracciones molares.
Normalidad
La normalidad también es una unidad de concentración química. La principal diferencia entre la normalidad y la molaridad es que la primera expresa la cantidad de soluto en términos del número de equivalente en lugar de moles.
El gran problema que presenta la normalidad para la mayoría de las personas es que, a diferencia de la molaridad, una misma solución puede tener más de una normalidad, ya que el concepto del número de equivalentes depende de para qué se utiliza el soluto o en qué tipos de reacción química el mismo participará.
Fórmulas para calcular la normalidad
Las fórmulas para calcular la normalidad son muy similares a las de la molaridad. La forma matemática de la definición de normalidad es:
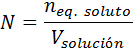
donde neq. soluto representa el número de equivalentes de soluto y Vsolución representa el volumen de la solución expresado en litros. Para calcular la normalidad a partir de la masa del soluto, existe también una fórmula similar a la de la molaridad:
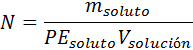
Donde PEsoluto (el peso equivalente del soluto) representa el peso en gramos de 1 equivalente de soluto. Este viene dado por la masa molar dividida entre un número entero que representa el número de equivalentes por mol de la sustancia, y al que llamaremos ω (la letra griega omega) para evitar confundirlo con el verdadero número de equivalentes (neq).
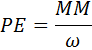
Al combinar esta ecuación con la anterior, obtenemos:
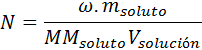
El concepto del número de equivalentes
La clave para comprender el concepto del número de equivalentes, y, de hecho, la razón por la que la concentración “normal” o normalidad se llama así, está en ω. Este número depende del uso que se le da al soluto o de la reacción química en la que participará.
Para cada tipo de reacción química importante que involucra por lo menos dos sustancias químicas, podemos definir lo que llamaremos el reactivo “Normal” que no es más que un término genérico que utilizamos para identificar al reactivo que participa en la versión más simple posible del tipo particular de reacción.
Por ejemplo, si hablamos de una reacción ácido-base, el caso más sencillo sería aquella en la que un ácido monoprótico cualquiera (HA) reaccionara con una base monobásica (B), para dar los respectivos pares conjugados:

El ácido monoprótico HA y la base monobásica B son lo que llamaríamos, respectivamente, un ácido y una base normales. Es decir que cualquier ácido como el HCl, o el HNO3 es un ácido normal, y cualquier base como el NaOH o el NH3 sería un ejemplo de una base normal.
Si ahora consideramos un ácido como el ácido sulfúrico (H2SO4) que es diprótico, la reacción con una base normal sería:

Como podemos ver, cada mol de este ácido “equivale” a 2 moles de un ácido normal. Por lo tanto, decimos que el número de equivalentes por mol del ácido sulfúrico es 2. Por esta razón, una solución 0,1 molar de H2SO4 equivale a una solución 0.2 molar de un ácido normal, por lo que decimos que la normalidad de dicha solución es 0,2.
En otras palabras, podemos redefinir el concepto de normalidad como la concentración molar que tendría un reactivo normal participando en el mismo tipo de reacción química que el soluto.
En la siguiente tabla se presenta la forma como se determina ω para cada tipo de soluto, en función de la reacción en la que estará involucrado:
| Tipo de reacción química | Tipo de reactivo | Número de equivalentes por mol (ω) |
| Reacciones que involucran sales | Sales | ω viene dado por el número total de cargas positivas o negativas en la sal neutra (ambos números son iguales). Se calcula multiplicando el número de cationes por su carga o el número de aniones por la suya. |
| Reacciones ácido base | Ácidos | ω viene dado por el número de hidrógenos que cede en la reacción. |
| Bases | ω viene dado por el número de hidrógenos que puede captar | |
| Reacciones Redox | Agente oxidantes | ω viene dado por el número de electrones que capta cada molécula de agente oxidante en la semirreacción balanceada de reducción. |
| Agente reductores | ω viene dado por el número de electrones cede cada molécula de agente reductor en la semirreacción balanceada de oxidación. | |
| Solutos que no participan en reacciones | ——- | ω vale 1eq/mol |
¿Cuándo conviene utilizar la normalidad?
A diferencia de la molaridad que se suele utilizar en cualquier contexto, la normalidad se utiliza principalmente en situaciones que involucran reacciones químicas en solución, ya que facilitan los cálculos estequiométricos sin necesidad de escribir las reacciones químicas balanceadas o ajustadas.
Debido a la forma en que se define el número de equivalentes por mol, el número de equivalentes de un reactivo siempre será igual al número de equivalentes del otro cuando reaccionan en proporciones estequiométricas. Como el número de equivalentes se puede hallar fácilmente a partir de la normalidad y el volumen de solución, podemos llevar a cabo cálculos estequiométricos muy rápidamente sin preocuparnos por los detalles de la reacción.
Esto resulta particularmente práctico en las valoraciones volumétricas o titulaciones, ya que, en el punto de equivalencia de la titulación, siempre se cumplirá que:
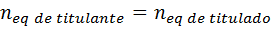
Y sustituyendo los equivalentes por el producto de la normalidad por el volumen, obtenemos:
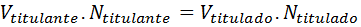
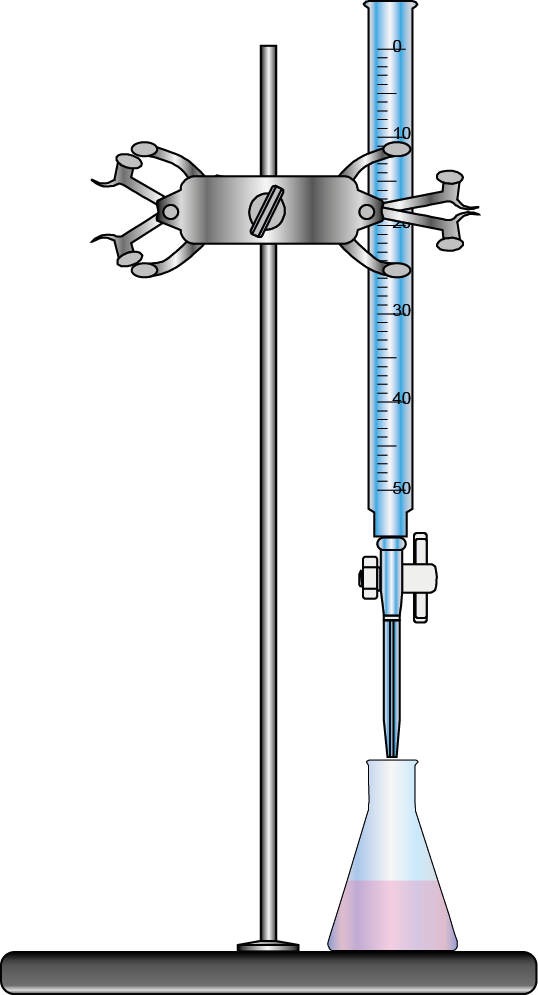
Algo similar se podría hacer con la molaridad, pero requiere inevitablemente que escribamos la ecuación química y la ajustemos para obtener las relaciones estequiométricas necesarias.
Conversión entre molaridad y normalidad
Convertir entre molaridad y normalidad es muy fácil, ya que la segunda siempre es un múltiplo entero de la primera como se muestra a continuación:
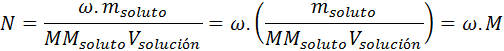
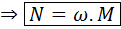
Si conocemos la molaridad de una solución, podemos calcular sus distintas normalidades simplemente multiplicando la molaridad por el respectivo número de equivalentes por mol, ω.



