Tabla de Contenidos
Los diagramas atómicos consisten en una representación simplificada de la configuración electrónica de un átomo por capas o niveles de energía. Son una manera muy sencilla de ver la capa de valencia de un elemento asó como el número de electrones presentes en las capas internas, lo cual resulta útil para la predicción de las propiedades físicas y químicas de un elemento.
¿Cómo se construyen los diagramas atómicos?
La construcción de los diagramas atómicos se basa en la configuración electrónica del elemento. Es un proceso relativamente sencillo que se lleva a cabo de la misma manera para cada átomo de la tabla periódica. El proceso es el siguiente:
Paso #1: Escribir la configuración electrónica del elemento
La configuración electrónica se obtiene utilizando la regla de la lluvia y el número total de electrones del átomo en cuestión. Si se trata de un átomo neutro, el número de electrones coincide con el número atómico del elemento. Si, por el contrario, se trata de un ion, el número de electrones se calcula como el número atómico menos la carga eléctrica del ion (incluyendo su signo si es negativa). Es decir, se utiliza la siguiente fórmula:
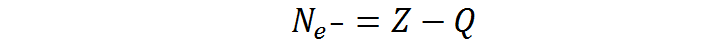
Una vez obtenido el número de electrones, se reparten en los distintos subniveles del átomo, llenando primero los de menor energía hasta que estén completamente llenos antes de pasar al siguiente orbital o subnivel. El orden de llenado viene determinado por la regla de Madelung, también conocida como la regla de la lluvia, y se esquematiza en la siguiente figura:

Es decir, el llenado se hace según la sumatoria de n+l, en lugar de únicamente considerar n. La lista de todos los subniveles con el número máximo de electrones que cabe en cada uno, siguiendo esta regla de llenado, es:
| 1s2 | 2s2 | 2p6 | 3s2 | 3p6 | 4s2 | 3d10 | 4p6 | 5s2 | 4d10 | 5p6 | 6s2 | 4f14 | 5d10 | 6p6 | 7s2 | 5f14 | 6d10 | 7p6 |
Existen más subniveles, pero ningún elemento de la tabla periódica alcanza a ubicar electrones en los mismos.
Paso #2: Agrupar los orbitales en orden creciente de nivel de energía
El llenado de los orbitales siguiendo el método de la lluvia no siempre produce la configuración electrónica ordenada por nivel principal de energía. Por esta razón, luego de llenar los subniveles, se deben agrupar por su valor de n o número cuántico principal.
Paso #3: Sumar los electrones en cada nivel de energía para obtener la configuración electrónica por capas
Una vez obtenida la configuración electrónica final sumamos el número de electrones en todos los orbitales presentes en cada nivel. De esta manera, se obtiene lo que se conoce como la configuración electrónica por niveles o por capas. Cada nivel principal de energía (i.e., cada valor de n), se identifica con una letra del abecedario en mayúscula, comenzando por la letra K, como se indica en la siguiente tabla:
| n | Capa | Número de e– |
| 1 | K | Máximo 2 |
| 2 | L | Máximo 8 |
| 3 | M | Máximo 18 |
| 4 | N | Máximo 32 |
| 5 | O | Máximo 50 |
| 6 | P | Máximo 72 |
| 7 | Q | Máximo 98 |
El número máximo de electrones se coloca como referencia para verificar que no hubo ningún error en el conteo o distribución de electrones. Un átomo puede poseer menos que el máximo en sus últimas capas electrónicas, pero nunca puede tener más de dicho número.
Paso #4: Hacer un diagrama con tantas circunferencias concéntricas como el período en el que está el elemento
Al tener la configuración por capas ya estamos listos para construir el diagrama atómico. Solo basta con dibujar una serie de círculos concéntricos alrededor del núcleo atómico. Se debe dibujar un círculo por cada capa que contiene electrones. Así, si la configuración por capas de un átomo es K2 L5, entonces se deben dibujar dos círculos, uno para la capa K (n=1) y otro para la capa L (n=2). El número de capas electrónicas de un elemento, coincide con el período en el que está ubicado en la tabla periódica.
Paso #5: Comenzando por la circunferencia más pequeña (n=1), repartir los electrones en cada nivel de energía hasta agotarlos todos
Finalmente, se dibujan sobre cada una de estas circunferencias un pequeño círculo por cada electrón que contenga la respectiva capa. En el ejemplo anterior, (K2 L5) debemos colocar dos electrones en la primera circunferencia y 5 en la segunda. Se debe hacer lo posible por repartir los electrones lo más uniformemente posible.
Ejemplos de la construcción de diagramas atómicos de los elementos
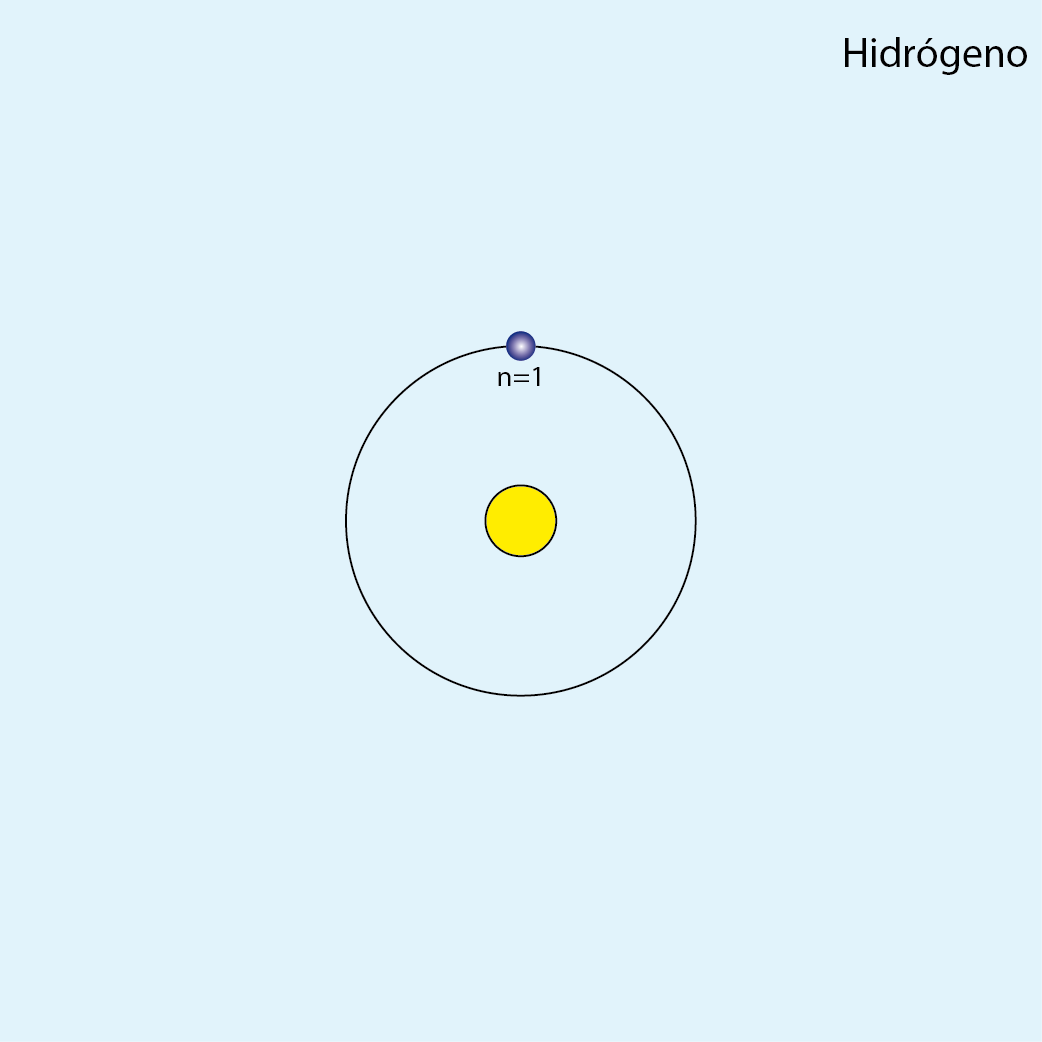
Hidrógeno (H, Z=1)
Número de electrones: 1
Configuración electrónica (método de la lluvia): 1s1
Número total de electrones por capa:
| n | Subniveles | Capa | Número de e– |
| 1 | 1s1 | K | 1 |
Configuración electrónica por capas: K1
Número de capas ocupadas: 1
Diagrama atómico del hidrógeno:
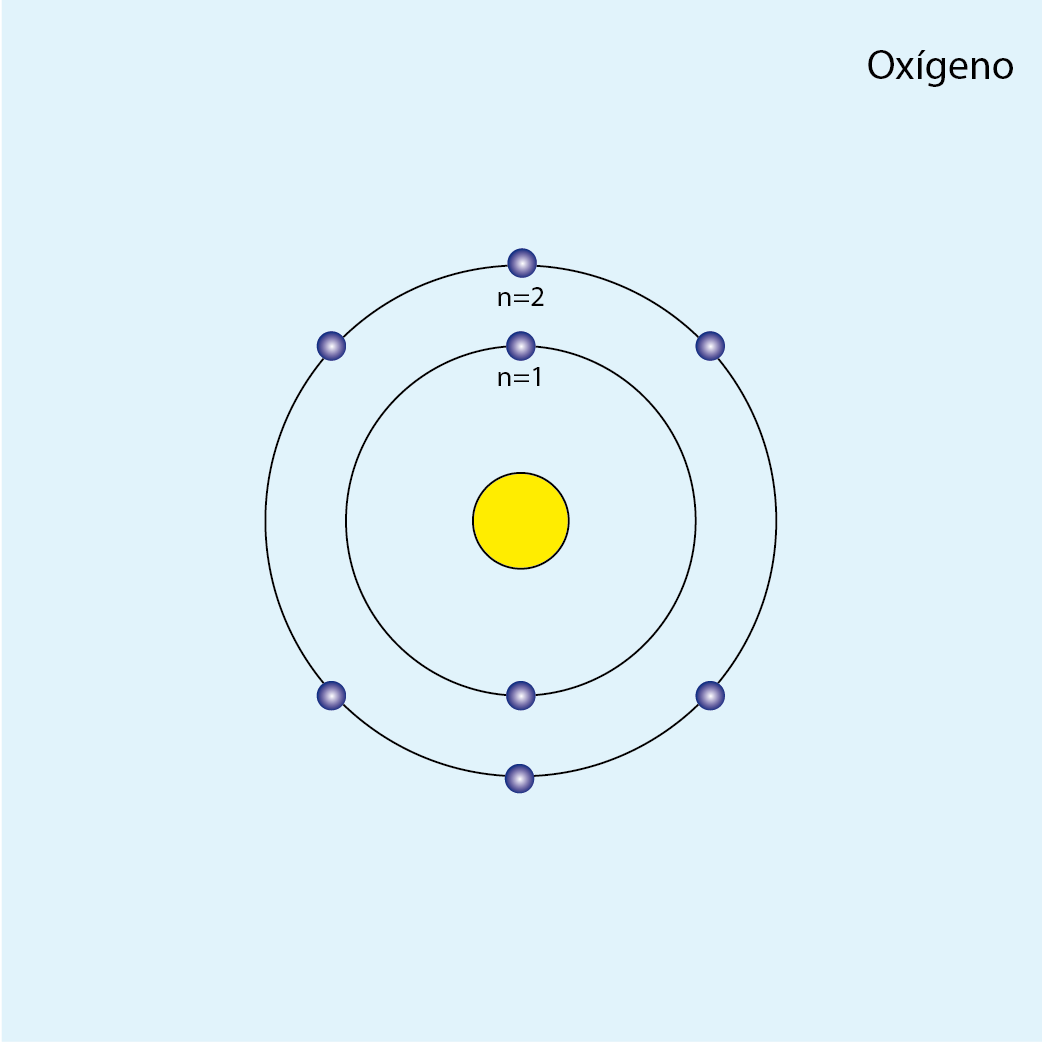
Oxígeno (O, Z=8)
Número de electrones: 8
Configuración electrónica (método de la lluvia): 1s2 2s2 2p4
Número total de electrones por capa:
| n | Subniveles | Capa | Número de e– |
| 1 | 1s2 | K | 2 |
| 2 | 2s2 2p4 | L | 6 |
Configuración electrónica por capas: K2 L6
Número de capas ocupadas: 2 (dos círculos concéntricos)
Diagrama atómico del oxígeno:
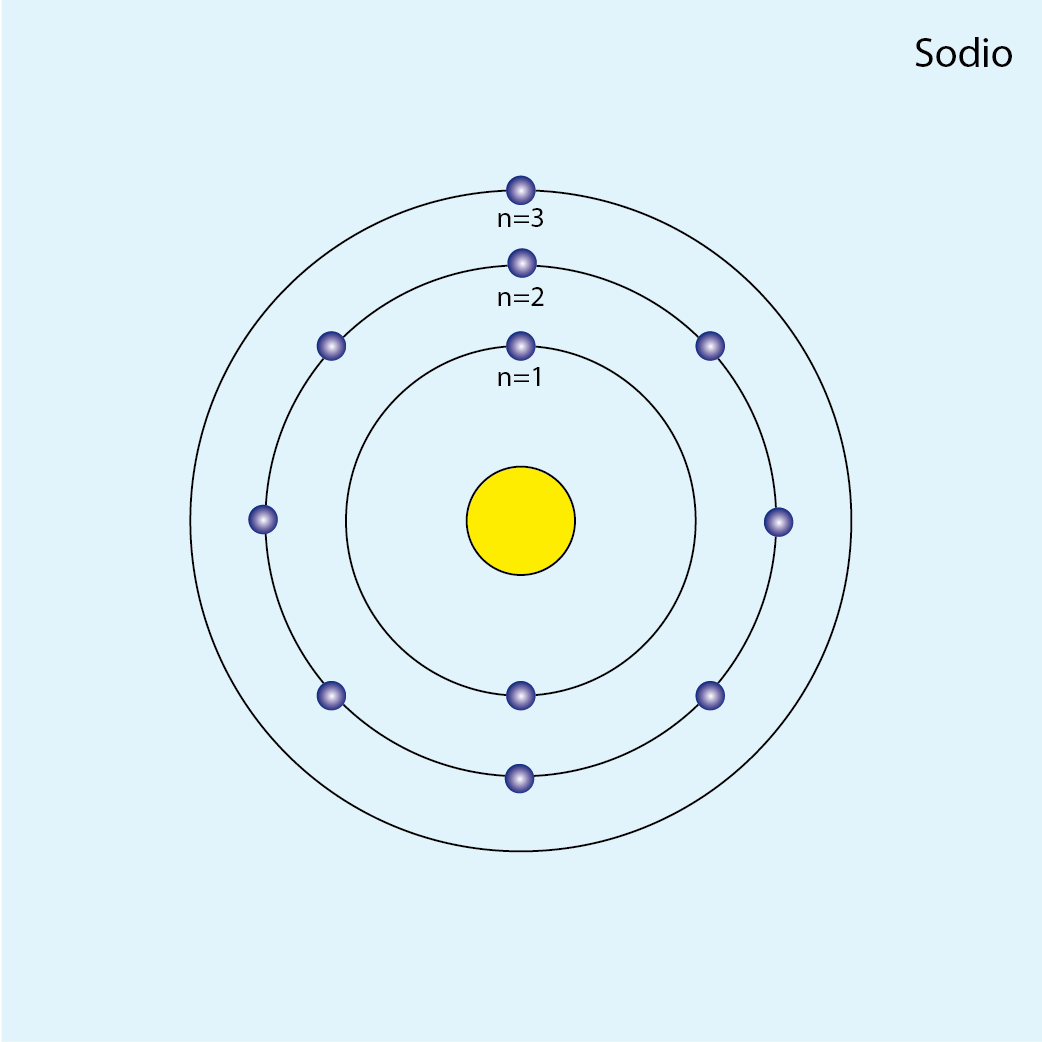
Sodio (Na, Z=11)
Número de electrones: 11
Configuración electrónica (método de la lluvia): 1s2 2s2 2p6 3s1
Número total de electrones por capa:
| n | Subniveles | Capa | Número de e– |
| 1 | 1s2 | K | 2 |
| 2 | 2s2 2p6 | L | 8 |
| 3 | 3s1 | M | 1 |
Configuración electrónica por capas: K2 L8 M1
Número de capas ocupadas: 3 (tres círculos concéntricos)
Diagrama atómico del sodio:
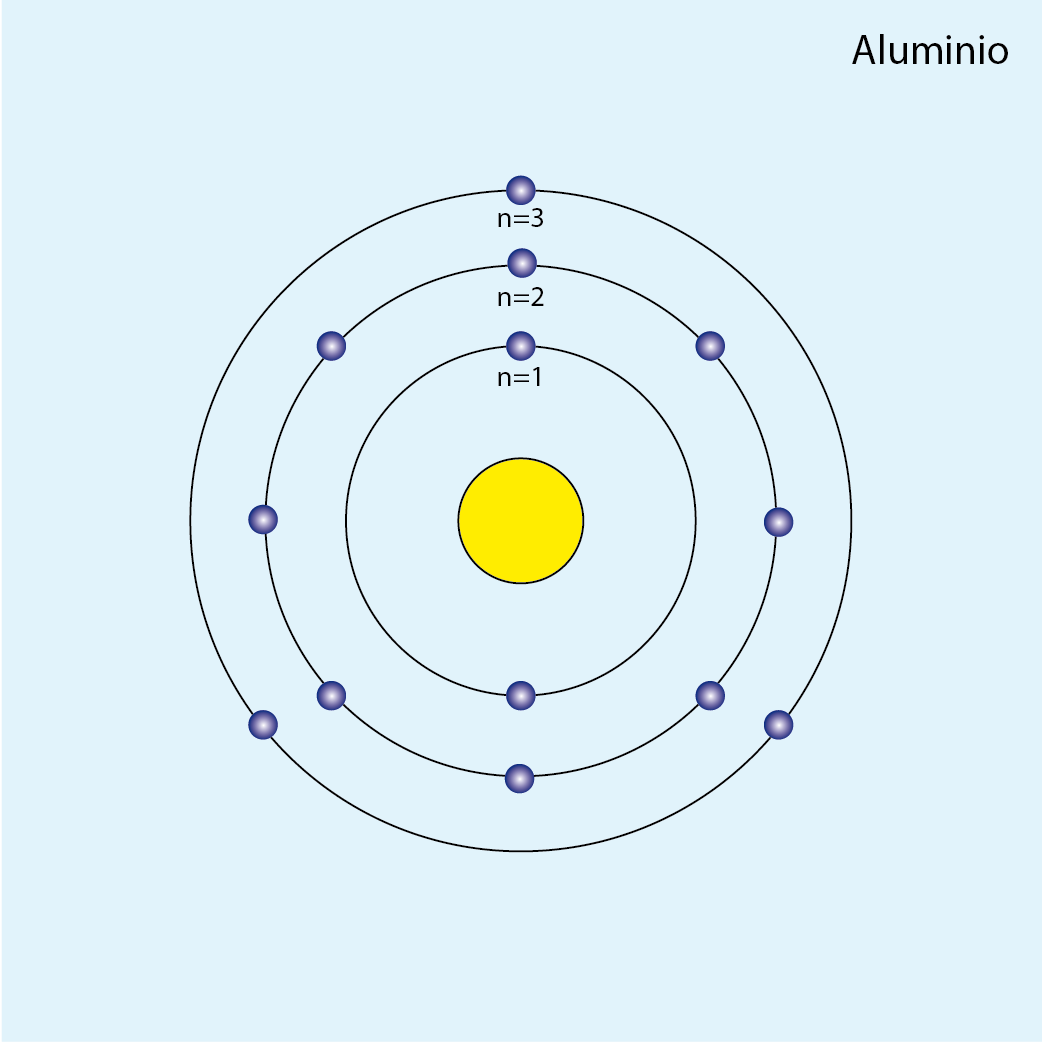
Aluminio (Al, Z=13)
Número de electrones: 13
Configuración electrónica (método de la lluvia): 1s2 2s2 2p6 3s2 3p1
Número total de electrones por capa:
| n | Subniveles | Capa | Número de e– |
| 1 | 1s2 | K | 2 |
| 2 | 2s2 2p6 | L | 8 |
| 3 | 3s2 3p1 | M | 3 |
Configuración electrónica por capas: K2 L8 M3
Número de capas ocupadas: 3 (tres círculos concéntricos)
Diagrama atómico del aluminio:
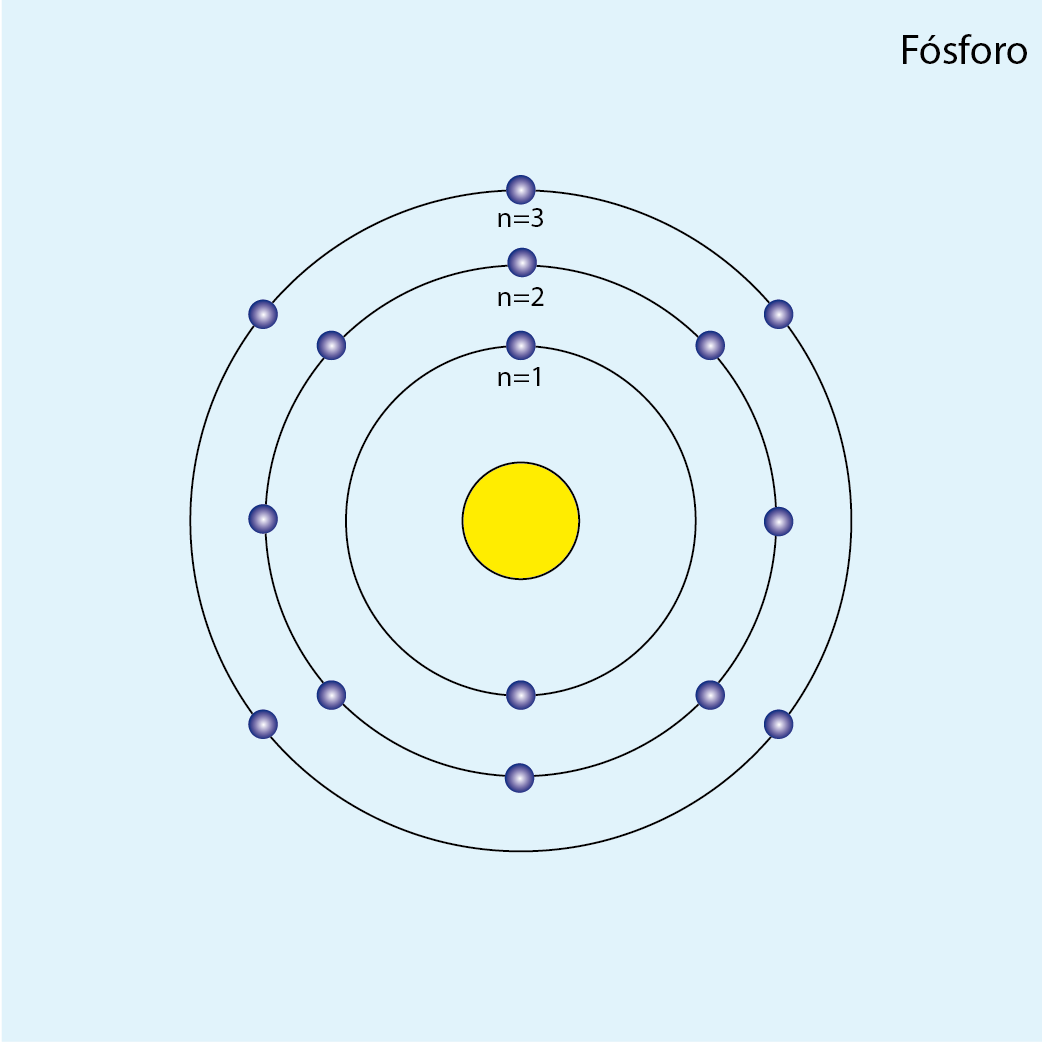
Fósforo (P, Z=15)
Número de electrones: 15
Configuración electrónica (método de la lluvia): 1s2 2s2 2p6 3s2 3p3
Número total de electrones por capa:
| n | Subniveles | Capa | Número de e– |
| 1 | 1s2 | K | 2 |
| 2 | 2s2 2p6 | L | 8 |
| 3 | 3s2 3p3 | M | 5 |
Configuración electrónica por capas: K2 L8 M5
Número de capas ocupadas: 3 (tres círculos concéntricos)
Diagrama atómico del Fósforo:
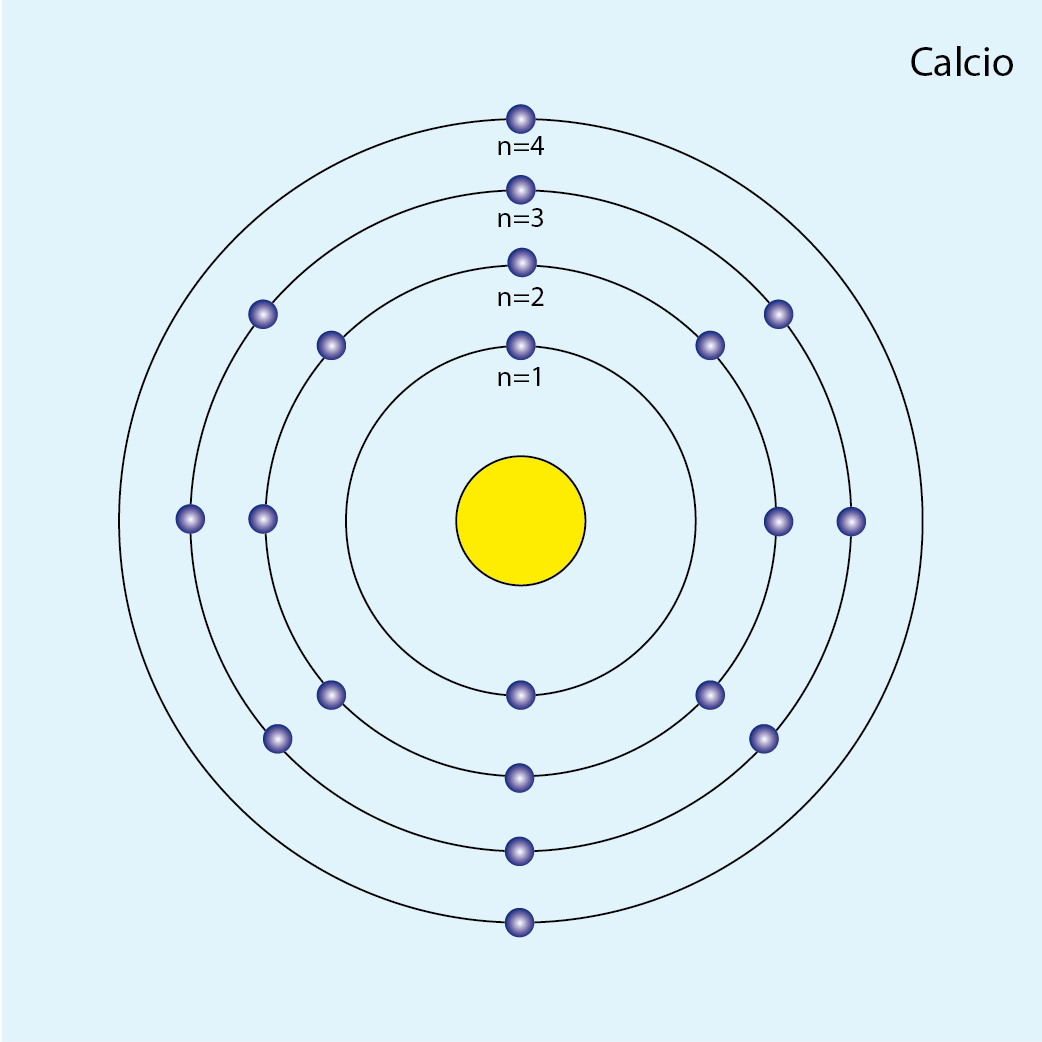
Calcio (Ca, Z=20)
Número de electrones: 20
Configuración electrónica (método de la lluvia): 1s2 2s2 2p6 3s2 3p6 4s2
Número total de electrones por capa:
| n | Subniveles | Capa | Número de e– |
| 1 | 1s2 | K | 2 |
| 2 | 2s2 2p6 | L | 8 |
| 3 | 3s2 3p6 | M | 8 |
| 4 | 4s2 | N | 2 |
Configuración electrónica por capas: K2 L8 M8 N2
Número de capas ocupadas: 4 (cuatro círculos concéntricos)
Diagrama atómico del calcio:
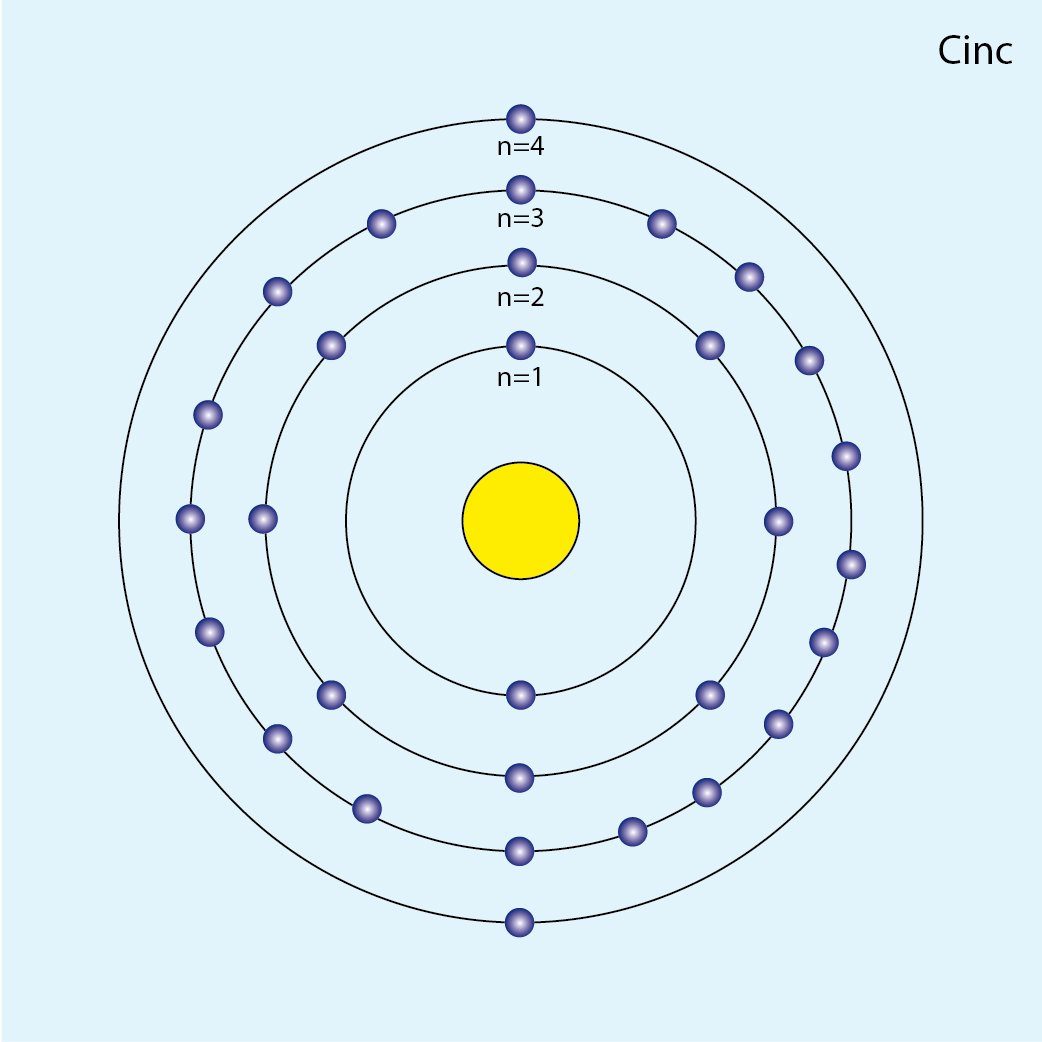
Cinc (Zn, Z=30)
Número de electrones: 30
Configuración electrónica (método de la lluvia): 1s2 2s2 2p6 3s2 3p6 4s2 3d10
Número total de electrones por capa:
| n | Subniveles | Capa | Número de e– |
| 1 | 1s2 | K | 2 |
| 2 | 2s2 2p6 | L | 8 |
| 3 | 3s2 3p6 3d10 | M | 18 |
| 4 | 4s2 | N | 2 |
Configuración electrónica por capas: K2 L8 M18 N2
Número de capas ocupadas: 4 (cuatro círculos concéntricos)
Diagrama atómico del cinc:
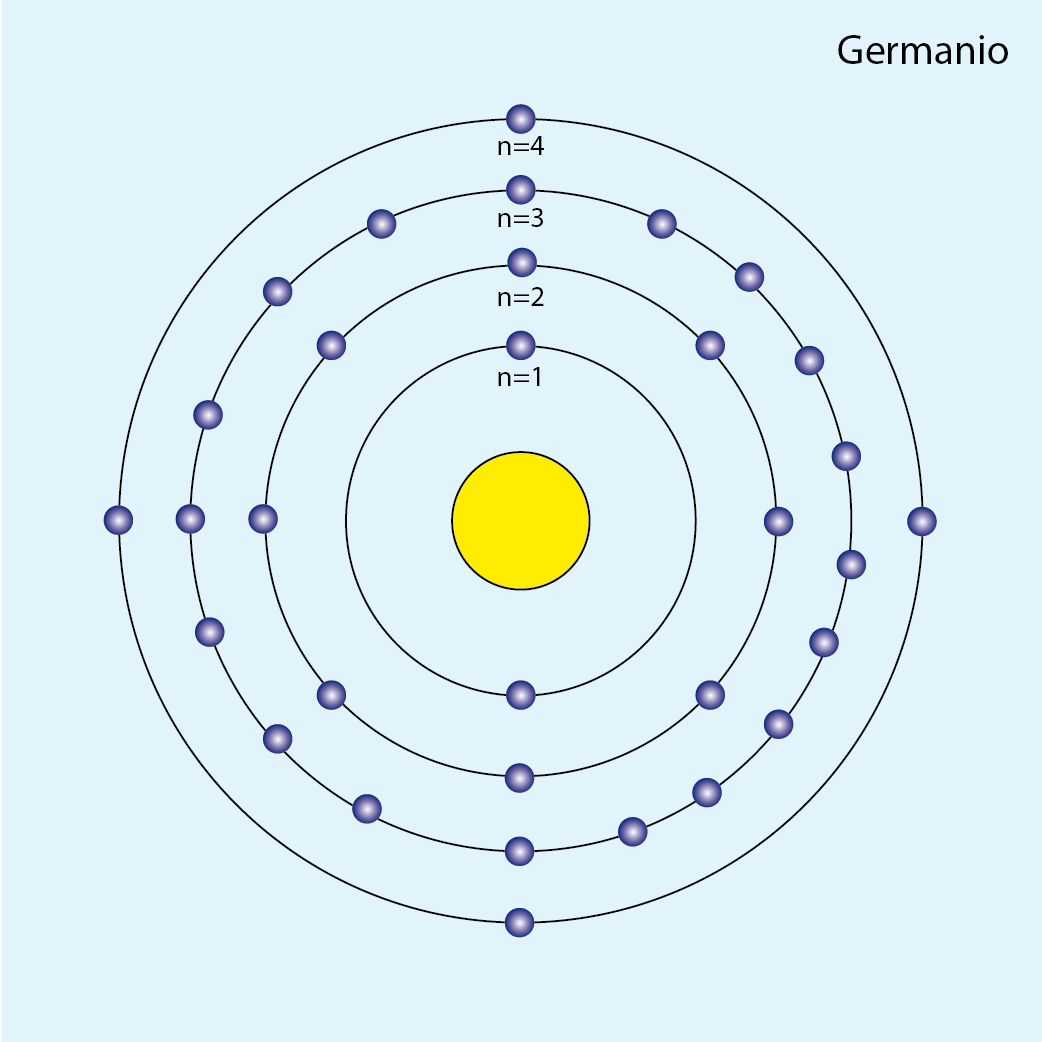
Germanio (Ge, Z=32)
Número de electrones: 32
Configuración electrónica (método de la lluvia): 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p2
Número total de electrones por capa:
| n | Subniveles | Capa | Número de e– |
| 1 | 1s2 | K | 2 |
| 2 | 2s2 2p6 | L | 8 |
| 3 | 3s2 3p6 3d10 | M | 18 |
| 4 | 4s2 4p2 | N | 4 |
Configuración electrónica por capas: K2 L8 M18 N4
Número de capas ocupadas: 4 (cuatro círculos concéntricos)
Diagrama atómico del germanio:
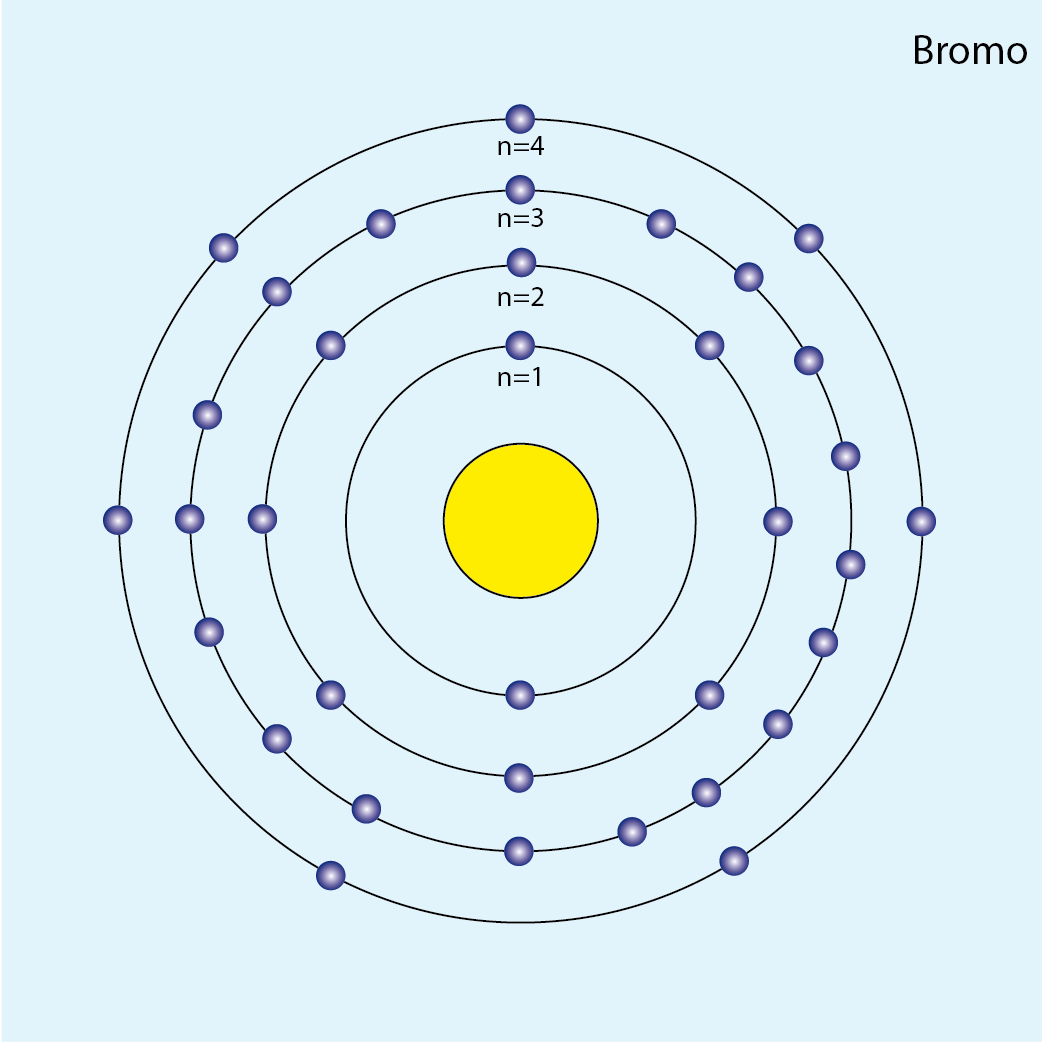
Bromo (Br, Z=35)
Número de electrones: 35
Configuración electrónica (método de la lluvia): 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p5
Número total de electrones por capa:
| n | Subniveles | Capa | Número de e– |
| 1 | 1s2 | K | 2 |
| 2 | 2s2 2p6 | L | 8 |
| 3 | 3s2 3p6 3d10 | M | 18 |
| 4 | 4s2 4p5 | N | 7 |
Configuración electrónica por capas: K2 L8 M18 N7
Número de capas ocupadas: 4 (cuatro círculos concéntricos)
Diagrama atómico del bromo:
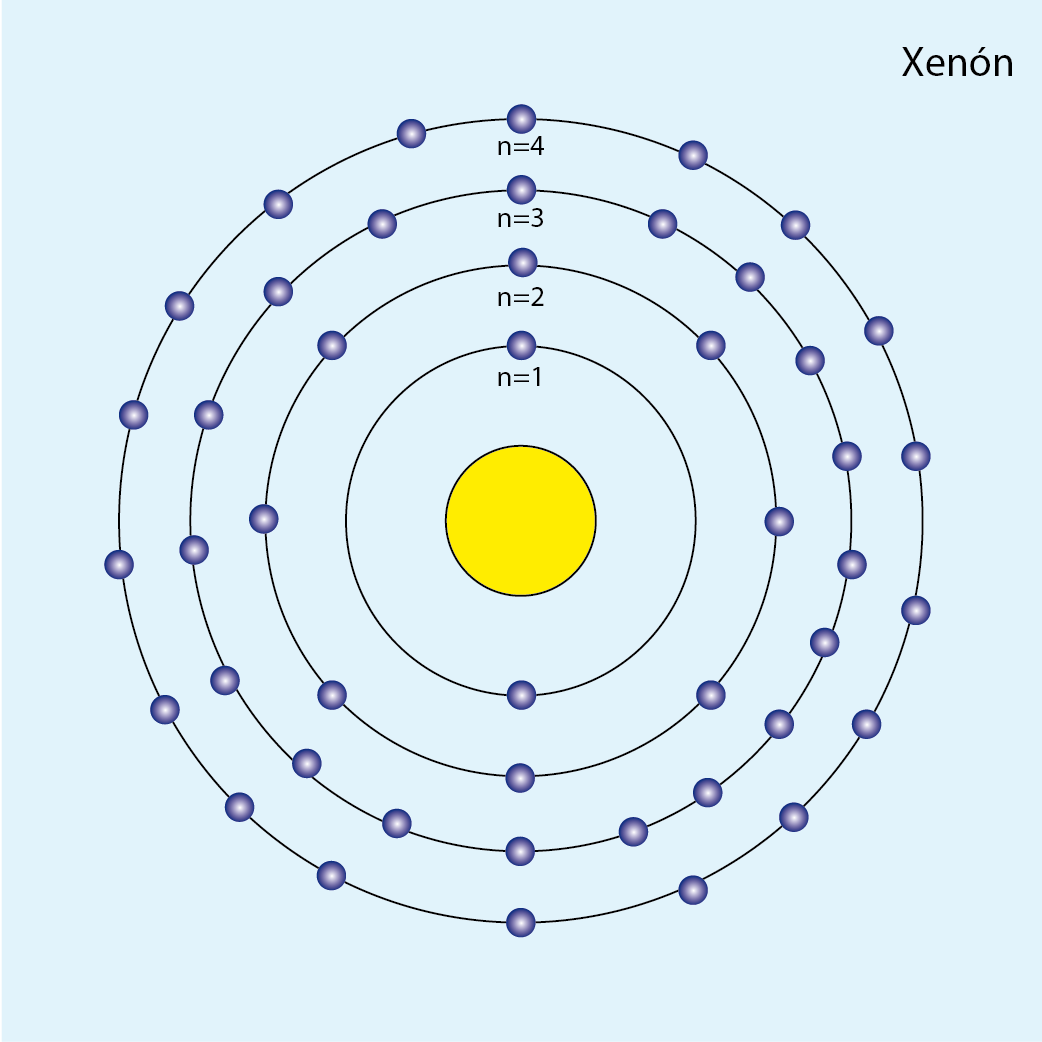
Xenón (Xe, Z=54)
Número de electrones: 54
Configuración electrónica (método de la lluvia): 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6 5s2 4d10 5p6
Número total de electrones por capa:
| n | Subniveles | Capa | Número de e– |
| 1 | 1s2 | K | 2 |
| 2 | 2s2 2p6 | L | 8 |
| 3 | 3s2 3p6 3d10 | M | 18 |
| 4 | 4s2 4p6 4d10 | N | 18 |
| 5 | 5s2 5p6 | O | 8 |
Configuración electrónica por capas: K2 L8 M18 N18 O8
Número de capas ocupadas: 5 (cinco círculos concéntricos)
Diagrama atómico del xenón:
Referencias
Chang, R., & Goldsby, K. (2013). Química (11th ed.). McGraw-Hill Interamericana de España S.L.
Miguel, J. (2020, July 14). Representación del átomo a partir del número atómico y el número másico utilizando el modelo planetario. EspacioCiencia.com. https://espaciociencia.com/representacion-del-atomo/
Montagud Rubio, N. (2022, February 15). Diagrama de Moeller: qué es, cómo se usa en Química, y ejemplos. Psicología y Mente. https://psicologiaymente.com/miscelanea/diagrama-moeller
Prototypes, C. L. (n.d.). Partes de una Actividad de Diagrama Atómico. Storyboard That. https://www.storyboardthat.com/es/lesson-plans/ensenanza-de-los-atomos/partes-del-%c3%a1tomo



