Tabla de Contenidos
También conocidas como reacciones de doble desplazamiento, doble descomposición o de metátesis, son aquellas en las cuales dos sustancias químicas reaccionan entre sí intercambiando grupos neutros o iones de igual carga para dar origen a dos compuestos nuevos en los cuales se presentan los mismos tipos de enlaces.
Las reacciones de doble reemplazo se pueden ver como un intercambio de parejas. Las dos parejas originales representan los dos reactivos de partida, y, luego de la reacción, se obtienen dos parejas nuevas.
Durante una reacción de metátesis o de doble reemplazo, uno de los grupos o iones de una de las moléculas desplaza a un grupo similar en la otra, mientras que uno de los grupos de la segunda desplaza a un grupo similar en la primera. Esta es la razón por la que se denominan reacciones de doble desplazamiento.
¿Cómo reconocer las reacciones de doble reemplazo?
Las reacciones de metátesis son fáciles de reconocer. En primer lugar, siempre involucran dos reactivos y dos productos. En segundo lugar, siempre siguen el siguiente esquema:

Tanto A como B, C y D puede corresponder a átomos individuales o a grupos de átomos. Como se puede observar en este esquema, el grupo A está desplazando o reemplazando al grupo C en la molécula CD, mientras que, al mismo tiempo, el grupo C reemplaza al grupo A (o el grupo D reemplaza al grupo D, dependiendo del punto de vista).
El enlace entre los grupos A y B y entre C y D puede ser tanto iónico como covalente. Lo único que importa es que el enlace que se forma en los dos productos sea del mismo tipo.
Tipos de reacciones de doble reemplazo
Dependiendo de los tipos de reactivos y de los tipos de productos que se formen, se pueden distinguir distintos tipos de reacciones de metátesis o doble reemplazo:
Metátesis de sales
En las reacciones de metátesis de sales ambos reactivos y ambos productos son sales (compuestos iónicos). El esquema general mostrado anteriormente, en el caso de la metátesis de sales se ve así:

En estos casos, los dos reactivos suelen ser sales solubles en agua o en otro solvente, mientras que uno de los dos productos es una sal insoluble que precipita.
Ejemplos de reacciones de doble reemplazo de sales
La mayoría de las reacciones de precipitación son reacciones de doble reemplazo. Algunos ejemplos son:

En esta reacción, los iones plata (I) y potasio se reemplazan el uno al otro para formar la sal insoluble cloruro de plata y la sal soluble nitrato de plata que queda en solución.

Aquí, los cationes sodio y bario se intercambian para dar sulfato de bario insoluble y cloruro de sodio que queda en solución.
Reacciones de neutralización ácido-base
Otra clase muy común de reacciones de doble desplazamiento son las reacciones de neutralización ácido base. Estas reacciones comienzan con la reacción entre una base (por ejemplo, un hidróxido metálico) y un ácido (que puede ser un ácido hidrácido, oxácido o un ácido orgánico) y da como productos una sal y agua:
Ejemplos de reacciones de neutralización ácido-base

Esta es una reacción entre un ácido fuerte (el ácido nítrico) y una base fuerte (el hidróxido de potasio). Sin embargo, también podría involucrar ácidos y bases débiles, como por ejemplo:
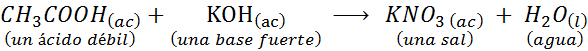
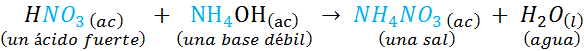
Reacciones de intercambio de metales
Este tipo de reacciones de doble reemplazo ocurren con los compuestos Organometálicos. A diferencia de los ejemplos anteriores que involucran el rompimiento y formación de enlaces iónicos, aquí se rompen y forman enlaces covalente coordinados entre un metal (que actúa como un ácido de Lewis) y in grupo orgánico que dona el par de electrones del enlace (el cual actúa como una base de Lewis).

Ejemplos de reacciones intercambio de metales
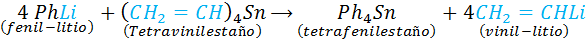
Reacciones orgánicas de doble desplazamiento
Las reacciones de sustitución que sufren los compuestos orgánicos como los haluros de alquilo y los alcoholes (por nombrar algunos) son también reacciones de doble reemplazo o doble desplazamiento. En ellas, el grupo entrante reemplaza al grupo saliente, mientras que este se une a la contraparte original del grupo entrante.
Ejemplos de reacciones orgánicas de doble desplazamiento
Un ejemplo de una reacción de sustitución nucleofílica en la que el bromo es sustituido por el yodo y viceversa se presenta a continuación.

Otro ejemplo es la hidrólisis de los ésteres. En este caso
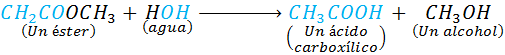
Referencias
Carey, F. (1999). Quimica Organica (3ra ed.). Madrid, España: McGraw-Hill Companies.
Chang, R., & Goldsby, K. A. (2012). Chemistry, 11th Edition (11th ed.). New York City, New York: McGraw-Hill Education.



