Tabla de Contenidos
Existen tres tipos básicos de enlaces químicos que mantienen a los átomos unidos entre sí, que son el enlace iónico, el enlace covalente y el enlace metálico. Adicionalmente, los enlaces covalentes se pueden dividir en varias clases dependiendo del número de electrones involucrados en el enlace, de la procedencia de los electrones (si vienen de uno o de ambos átomos) y de la uniformidad de la distribución de la densidad electrónica alrededor de ambos núcleos. El enlace polar se define como un tipo de enlace covalente en el que los átomos no comparten los electrones de forma equitativa, debido a que tienen diferentes electronegatividades.
Se debe recordar que un enlace covalente es aquel en el cual uno o más pares de electrones de valencia son compartidos entre dos átomos, lo cual los mantiene unidos.
La razón por la que se denominan enlaces polares es que, en este tipo de enlace, la densidad electrónica está levemente desplazada hacia el elemento más electronegativo, por lo cual éste adquiere una carga parcialmente negativa (que se representa por el símbolo δ-) mientras que el otro átomo adquiere una carga parcialmente positiva (que se representa por el símbolo δ+). Visto de esta manera, el enlace es un dipolo eléctrico, ya que posee un polo positivo y uno negativo.
El enlace polar y la diferencia de electronegatividad
La electronegatividad de un átomo es un número que representa su capacidad de atraer electrones cuando está enlazado químicamente a otro átomo. Esta propiedad se mide en una escala que va desde 0,65 para el francio, hasta 4,0 para el flúor, los cuales son los elementos menos y más electronegativos, respectivamente.
La electronegatividad está íntimamente ligada al enlace químico y, de hecho, determina en muchos casos el tipo de enlace que se formará entre dos átomos de elementos diferentes. Si la diferencia es grande, el enlace será iónico, y si es muy pequeña o no hay diferencia, entonces el enlace será covalente. Pero si la diferencia es intermedia, entonces estaremos en presencia de un enlace polar.
Pero esto trae a colación una pregunta muy importante: ¿Cómo saber cuándo la diferencia es suficientemente grande para definir un enlace iónico, o suficientemente pequeña para definir uno covalente puro?
En vista de que el carácter iónico y covalente no cambia de forma abrupta sino gradual, los límites entre uno y otro tipo de enlace son algo difusos. Sin embargo, los químicos establecieron la siguiente convención que permite definir de forma más clara lo que es un enlace covalente polar:
| Tipo de enlace | Diferencia de electronegatividad | Ejemplo |
| Enlace iónico | >1,7 | NaCl; LiF |
| Enlace polar | Entre 0,4 y 1,7 | O-H; H-F; N-H |
| Enlace covalente no polar | < 0,4 | C-H; C-I |
| Enlace covalente puro | 0 | H-H; O-O; F-F |
Los enlaces polares y el momento dipolar
Ya se aclaró que los enlaces polares son dipolos eléctricos. Los dipolos eléctricos se caracterizan por algo denominado el momento dipolar, que es un vector que se representa con la letra griega μ (mu), que apunta desde el átomo menos electronegativo hacia el más electronegativo.
La magnitud del momento dipolar viene dada por el producto entre la carga que hay en los polos y la longitud del dipolo (en este caso, la longitud del enlace). En el caso de los enlaces polares, el momento dipolar es proporcional a la diferencia de electronegatividades entre los dos átomos enlazados.
El enlace polar y la polaridad
Cuando una molécula posee un solo enlace polar, entonces la molécula como un todo posee un momento dipolar, y se dice que la molécula es polar. La polaridad es una propiedad muy importante en los compuestos moleculares ya que determina propiedades tales como la solubilidad en diferentes solventes, los puntos de fusión y ebullición, entre otras propiedades.
Cabe destacar, sin embargo, el hecho de poseer enlaces polares no asegura que una molécula sea polar. Cuando una molécula posee más de un enlace polar, la polaridad total de la molécula vendrá dada por la suma de los momentos dipolares de todos sus enlaces polares. Estos momentos dipolares se suman como vectores. Por esta razón, se puede dar el caso en el que los momentos dipolares de los distintos enlaces polares se cancelen entre sí, y la molécula como tal será apolar, a pesar de poseer enlaces polares. Sin no se cancelan, entonces la molécula será polar.
Ejemplos de enlaces polares
Los enlaces polares se dan, en la mayoría de los casos, entre elementos no metálicos. Como regla general, mientras más alejados se encuentren en la tabla periódica, mayor será la diferencia de electronegatividades entre los dos átomos y, por lo tanto, mayor será el momento dipolar del enlace, i.e. el enlace será más polar.
A continuación, se presentan algunos ejemplos de enlaces polares representativos que surgen con mucha frecuencia en química orgánica:
El enlace O-H
Existen muchos compuestos moleculares que presentan enlaces O-H. El más notorio es, por supuesto, el agua, cuya fórmula molecular es H2O, y el cual posee dos enlaces O-H. Sin embargo, existen incontables otros compuestos con este tipo de enlace incluyendo los alcoholes, fenoles, ácidos carboxílicos y muchos más.

La diferencia de electronegatividad entre el oxígeno y el hidrógeno es de 1,24 lo que lo hace
Enlace C-O

El enlace C-O es otro ejemplo muy común en muchos compuestos orgánicos incluidos los alcoholes, éteres, ácidos y muchos compuestos más. La diferencia de electronegatividad entre el carbono y el oxígeno es de 0,89. Este enlace es el responsable de la polaridad de los éteres, y es parcialmente responsable de la polaridad de muchos otros compuestos.
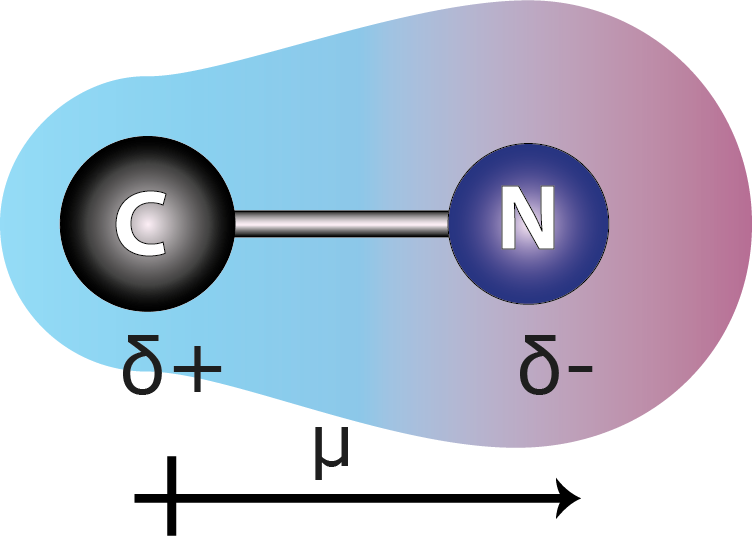
Enlace C-N

Las aminas, las amidas y muchísimos otros compuestos, incluidos el ADN y todas las proteínas contienen múltiples enlaces C-N. Con una diferencia de electronegatividad de 0,49, este enlace está cerca del límite entre enlace polar y enlace covalente no polar.
Enlace N-H
La diferencia de electronegatividad entre el nitrógeno y el hidrógeno es de 0,84, haciendo de este un enlace bastante polar. De hecho, esta polarización del enlace hace que el hidrógeno unido al nitrógeno pueda formar parte de un tipo especial de enlace covalente entre tres núcleos denominado enlace de hidrógeno, el cual es responsable de muchas propiedades de los compuestos que los pueden formar.
Enlace C=O
Este es un ejemplo importante ya que resalta el hecho de que la polaridad de un enlace covalente es un concepto independiente del orden de enlace. Un enlace puede ser polar o no polar independientemente de si se trata de un enlace simple, doble o triple.
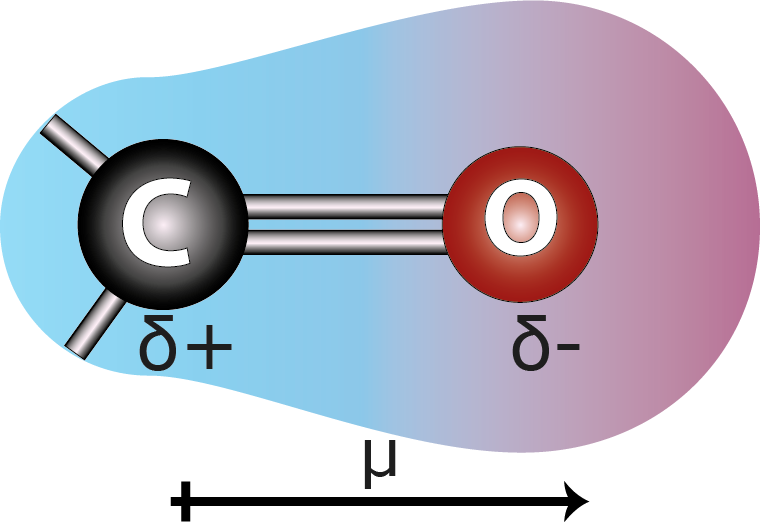
En vista de esto, el enlace C=O sigue siendo polar, independientemente del hecho de que sea un enlace doble. Sin embargo, sí existe una diferencia en la polaridad, ya que las electronegatividades de los elementos dependen de la hibridación. En este caso, tanto el carbono como el oxígeno tienen hibridación sp2 lo que los hace a ambos más electronegativos, pero sigue habiendo una diferencia de electronegatividades entre los dos.
El Enlace H-F – Una excepción a la regla
Como se mencionó anteriormente, los límites entre el carácter covalente y iónico son difusos, y la definición de enlace polar en función de la diferencia de electronegatividad puede presentar excepciones. Una muy común es el fluoruro de hidrógeno o HF.
Para este compuesto, la diferencia de electronegatividades es de 1,78. Esto, según la definición anterior, colocaría al HF dentro de los compuestos iónicos. Sin embargo, lo que hace a un compuesto ser iónico o covalente no es solamente su diferencia de electronegatividad, sino también (y, de hecho, principalmente) sus propiedades físicas y químicas.
El enlace iónico se caracteriza por ser muy fuerte y por generar sólidos cristalinos con puntos de fusión y ebullición muy altos. Sin embargo, el HF es un gas a temperatura ambiente, ya que su punto de ebullición es de apenas 19,5 ºC. Compárese con el punto de ebullición del cloruro de sodio que es 1.465 ºC.
Además, el HF está formado por dos no metales en lugar de por un no metal y un metal, como es el caso de los compuestos iónicos. Por estas dos razones, el HF se considera un compuesto covalente polar, a pesar de la alta diferencia en electronegatividades entre el hidrógeno y el flúor.
Enlace S-H – Otra excepción
El enlace S-H es un ejemplo de un enlace covalente que se considera polar, a pesar de no cumplir con la condición de la diferencia de electronegatividad. En este caso, la diferencia es de 0,38, lo cual lo pondría en el grupo de los enlaces covalentes no polares, sin embargo, los químicos están de acuerdo en que el enlace es, de hecho, polar.



