Tabla de Contenidos
En las ciencias, y en química en particular, se entiende por número exacto aquel número cuyo valor se conoce con exactitud y con absoluta certeza. Es decir, se trata de números cuyo valor no admite ninguna incertidumbre, y que posee infinitas cifras significativas cuyos valores conocemos de antemano.
Aprender a distinguir entre los números exactos y su contraparte, los números inexactos o medidos, es de gran importancia en la química y en la ciencia en general, ya que determina cuáles de los números debemos tener en cuenta para llevar a cabo un análisis de incertidumbre cuando hacemos cálculos. Este tipo de análisis es esencial en muchas ramas de la química, pero especialmente en el área de la química analítica. En dicha área, las incertidumbres son indispensables para determinar con seguridad algunos parámetros de gran importancia relacionados con los métodos analíticos, tales como los límites de detección y de cuantificación.
Características de los números exactos
Las principales características de los números exactos son:
- Su valor no tiene asociada ninguna incertidumbre.
- Poseen un número infinito de cifras significativas.
- Al no tener incertidumbre, no afectan la incertidumbre de cantidades calculadas a partir de ellos. Es decir, no influyen en el número de cifras significativas durante los cálculos.
- No son números medidos.
- Se generan bien sea por una definición arbitraria (como cuando definimos a una docena como 12 unidades de algo) o del proceso de contar unidades de algún tipo (como cuando contamos el número de comprimidos en un blíster de un medicamento).
- En la mayoría de los casos son números enteros, aunque hay excepciones.
¿Cómo identificar un número exacto en química?
La observación de la lista de características anteriores puede ser suficiente para aprender a identificar cuándo estamos en presencia de un número exacto y cuando no. Sin embargo, al ser una ciencia experimental, en la química se suelen manejar una gran variedad de magnitudes y variables, por lo que puede resultar confuso distinguir cuáles de estos números son exactos.
En vista de lo anterior, a continuación presentamos una serie de criterios que servirán para identificar, sin lugar a dudas, si un número es exacto o no. En este sentido, un número será exacto si:
El número se obtiene contando unidades de algo.
Cuando contamos unidades como manzanas, peras o el número de veces que repetimos un experimento, obtenemos siempre un número exacto. Por ejemplo, en química muchas veces llevamos a cabo cálculos estadísticos en los que se debe contar el número de veces que se lleva a cabo un experimento, el número de muestras que se analizaron o el número de veces que se repitió determinado evento o resultado. En todos estos casos, los números obtenidos son exactos.
EL número corresponde a una relación estequiométrica.
En toda reacción química, podemos escribir relaciones de números enteros simples entre los números de átomos o moléculas de los reactivos y/o productos, o entre el número de moles de los reactivos y/o productos. Estas relaciones, que se conocen como relaciones estequiométricas, las podemos utilizar para llevar a cabo cualquier cálculo estequiométrico que deseemos. En vista de que los números con los que se establecen las relaciones estequiométricas provienen de contar y son, por lo tanto, números exactos; en ese caso las relaciones estequiométricas establecidas en términos de números de átomos y moléculas o de moles también serán números exactos. Sin embargo, no se puede decir lo mismo acerca de las relaciones estequiométricas establecidas en términos de las masas atómicas y moleculares, ya que estas son cantidades determinadas experimentalmente.
El número corresponde a la definición de alguna unidad en un sistema de unidades determinado.
En todos los sistemas de unidades de importancia, se ha hecho un esfuerzo por definir todas las unidades fundamentales no en términos de cantidades medidas, sino en términos de, o bien cantidades contables, o bien como números puros hasta cierto punto arbitrarios. Un ejemplo es la definición del segundo en el sistema internacional, que consiste en “la duración de 9.192.631.770 oscilaciones de la radiación emitida en la transición entre los dos niveles hiperfinos del estado fundamental del isótopo 133 del átomo de cesio… a una temperatura de 0 K”. El número de oscilaciones es un número que se puede contar de manera exacta, lo que hace de esta una definición de un número exacto.
El número consiste en un factor de conversión entre dos unidades.
Los factores de conversión que utilizamos para llevar a cabo transformaciones de una unidad a otra son números exactos. Esto es consecuencia del hecho que las definiciones de las unidades también sean números exactos.
Se trata de un número racional puro que actúa como constante en una fórmula matemática.
Además de los números que contamos o que seleccionamos para definir nuestras unidades de medida, es habitual encontrarnos con otros números exactos en la química. Este es el caso de aquellos números constantes que aparecen de manera natural durante el proceso de deducción de algunas ecuaciones. Por ejemplo, la fórmula para calcular el volumen de una esfera es:
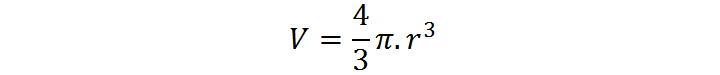
En este caso, el factor 4/3 que multiplica a todo el miembro derecho de la ecuación es un número racional exacto. En cambio, el número π (pi) no puede ser un número exacto ya que se trata de un número irracional, lo que implica que posee un número infinito de decimales que no siguen ningún patrón.
La incertidumbre y las cifras significativas
Al ser una ciencia experimental, la química implica la medición de una gran variedad de magnitudes y variables experimentales con diversos grados de exactitud y de incertidumbre. Todo instrumento científico está capacitado para medir con un cierto grado de apreciación, razón por la cual solo nos aporta una cantidad de información limitada acerca de aquello que estamos midiendo, dejando diferentes niveles de incertidumbre.
Esta incertidumbre se ve reflejada en el resultado de la medición en la forma de un número limitado de cifras significativas, es decir, de aquellas cifras que aportan información real de la medida. En términos generales, mientras mayor sea el número de cifras significativas, menor será la incertidumbre de una medida.
Pero, ¿por qué es importante considerar las cifras significativas?
Porque, al llevar a cabo cálculos con valores que no sean exactos, la incertidumbre de estos valores se propaga hacia el resultado del cálculo. Para determinar hasta qué punto se propagó esta incertidumbre, se deben seguir un conjunto de reglas lógicas para determinar cómo trabajar con las cifras significativas.
Sin embargo, como los números exacto no tienen límite en cuanto a la cantidad de cifras significativas, entonces no afectan el número de cifras significativas del resultado.
Ejemplos de números exactos en química
Ejemplos de números exactos por conteo
- El número de elementos analizados en una muestra.
- El número de estudiantes que forman parte de un grupo.
- El número de veces que se lleva a cabo una extracción con disolventes.
- El número de analitos (componentes de interés analítico) presentes en una muestra.
- El número de electrones de valencia.
- El número de protones o neutrones en el núcleo.
- El número de masa de un isótopo particular de cualquier elemento.
Ejemplos de números exactos por definición
- La definición de segundo como el número de oscilaciones a 0 K de la radiación emitida por un átomo del isótopo 130 del cesio.
- El número de partículas en un mol que se define como exactamente 6,02214076 x 1023.
- La velocidad de la luz, cuyo valor se fijó en 299.792.458 metros por segundo.
- La definición del metro como la distancia que recorre la luz en el vacío en un tiempo de 1/299.792.458 segundos.
Ejemplos de factores de conversión exactos
- 1.000 metros por cada 1 kilómetro.
- 1 pulgada que equivale a exactamente 2,54 centímetros.
- 1 milisegundo por cada 10-3 segundos.
- 1 hora por cada 60 minutos.
Referencias
Chang, R. (2021). Quimica (11.a ed.). MCGRAW HILL EDDUCATION.
Definition of Exact numbers in Chemistry. (s. f.). Kolibri. http://kolibri.teacherinabox.org.au/modules/en-boundless/www.boundless.com/chemistry/definition/exact-numbers/index.html
Helmenstine, A. (2021, 20 septiembre). What Is an Exact Number? Definition and Examples. Science Notes and Projects. https://sciencenotes.org/what-is-an-exact-number-definition-and-examples/
Libretexts. (2021, 19 mayo). 1.4: Measurements and Exact Numbers. Chemistry LibreTexts. https://chem.libretexts.org/Courses/Modesto_Junior_College/Chemistry_142%3A_Pre-General_Chemistry_(Brzezinski)/CHEM_142%3A_Text_(Brzezinski)/01%3A_Introduction/1.04%3A_New_Page
Mott, V. (s. f.). Exact Numbers | Introduction to Chemistry. Lumenlearning. https://courses.lumenlearning.com/introchem/chapter/exact-numbers/
Redefinición del mol. (2018, mayo). Latu.org. https://www.latu.org.uy/wp/wp-content/uploads/2018/05/Redefinici%C3%B3n-del-mol.pdf



