Tabla de Contenidos
En química, un ligando es un átomo, molécula o ion, sea este monoatómico o poliatómico, que cede un par de electrones no compartido (par de electrones libres) para formar un enlace covalente dativo o coordinado con un átomo neutro o catión central. Al compuesto así formado se le suele denominar complejo de coordinación.
Dependiendo de la carga eléctrica del ligando y del átomo o ion central, el complejo coordinado puede o no tener carga eléctrica neta. Si es neutro se suele considerar como compuesto de coordinación, y si es iónico se denomina ion complejo. Además, cualquier sal formada por un ion complejo con un contraión adecuado se denomina sal compleja.
Los ligandos pueden tener estructuras y composiciones muy diversas. Sin embargo, todo ligando debe tener por lo menos un átomo que posea un par de electrones de valencia libres o no compartidos disponibles para la formación del enlace coordinado. A este átomo (o a estos átomos, ya que algunos ligandos poseen más de uno) se le denomina átomo donante ya que es el que aporta los electrones del enlace covalente dativo.
Los ligandos como bases de Lewis
Como se deduce de su definición, los ligandos son en realidad bases de Lewis, ya que son especies ricas en electrones que poseen pares de electrones libres y que tienen la capacidad de ceder dichos electrones a un ácido de Lewis. Por esta razón, las reacciones químicas entre un ligando y un átomo central (casi siempre un elemento metálico) o un catión no son más que reacciones ácido-base.
Clasificación de los ligandos
Como sucede en muchos casos, existen varias formas de clasificar a los ligandos. Los criterios más utilizados son:
- El número de átomos que los conforman.
- La carga eléctrica.
- El número de átomos donantes de pares de electrones.
- Según el tipo de orbital atómico o molecular en el que se encuentren los electrones donados.
Clasificación según el número de átomos que los conforman
Ligandos monoatómicos
Como su nombre lo indica, son aquellos que están formados por solo un átomo. Suele tratarse de aniones monoatómicos tales como el ion fluoruro (F–) o el cloruro (Cl–).
Ligandos poliatómicos
Son los ligandos que están formados por dos o más átomos. Son por mucho los más comunes e incluyen ligandos como la molécula de agua (H2O), el oxígeno molecular (O2), el ion hidróxido (OH–) etc.
Clasificación según su carga eléctrica
Ligandos neutros
Son los ligandos que no tienen carga eléctrica neta. Es decir, son especies moleculares que poseen grupos con átomos como O, N, S, P o algunos de los halógenos.
Ejemplos de ligandos neutros
| El agua (H2O) | El amoníaco (NH3) | Los éteres (R-O-R’) | Las aminas (R3N) |
| Fosfina (PH3) | Los tioéteres (R-S-R’) | Monóxido de carbono o carbonilo (CO) |
Ligandos aniónicos o con carga negativa
Muchos ligandos son grupos que tienen un exceso de electrones y por lo tanto poseen una carga neta negativa. Estos aniones son ligandos muy comunes y se caracterizan por tener la carga negativa generalmente sobre un átomo muy electronegativo tal como el O, N o un halógeno, el cual es a su vez el átomo donante. Pueden tener una o más cargas negativas.
Ejemplos de ligandos aniónicos o con carga negativa
| Ion cloruro (Cl–) | Ion fluoruro (F–) | Ion bromuro (Br–) | Ion yoduro (I–) |
| Ion hidróxido (OH–) | Ion Cianuro (CN–) | Ion carbonato (CO32-) | Alcóxidos (R-O–) |
Clasificación según el número de átomos donantes de pares de electrones (hapticidad)
Algunos ligandos que solo se pueden unir a un centro metálico a través de un enlace coordinado, mientras que otros lo pueden hacer a través de 2 o más. Esto da origen a los siguientes tipos de ligandos:
Ligandos monodentados
Son los ligandos que solo poseen un átomo donante por lo que solo pueden formar un enlace covalente coordinado con el centro metálico.
Ejemplos de ligandos monodentados
| Agua (H2O) | El amoníaco (NH3) | Los éteres (R-O-R’) | Ion cloruro (Cl-) |
| Fosfina (PH3) | Los tioéteres (R-S-R’) | Las aminas (R3N) | Ion hidróxido (OH-) |
Ligandos polidentados o agentes quelantes
Muchos ligandos poseen más de un átomo donante y su estructura permite que el ligando se enlace al centro metálico con más de un enlace coordinado. En la estructura final, el ligando rodea al átomo central como si se tratara de una boca que lo muerde, con los átomos donantes actuando como los dientes (de allí el nombre polidentados). A los complejos que se forman por la unión de un ligando polidentado con un centro metálico se le denomina quelato, por lo que al ligando también se le denomina agente quelante (aquél que forma un quelato).
Algunos agentes quelantes poseen dos átomos donantes, en cuyo caso se denominan ligandos bidentados (el prefijo bi- significa 2).
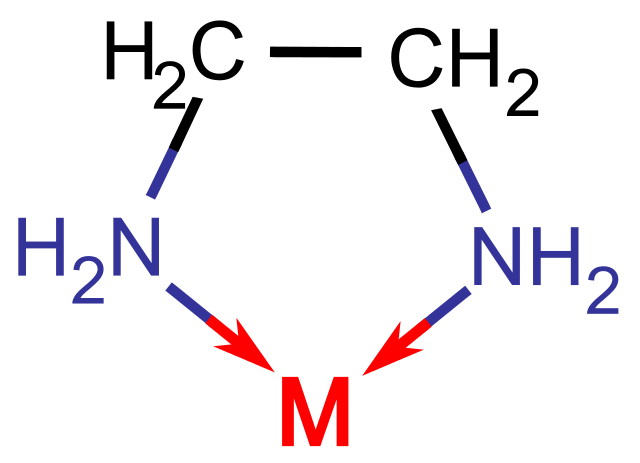
Los que tienen tres átomos donantes se denominan ligandos tridentados, los de cuatro tetradentados y así sucesivamente.
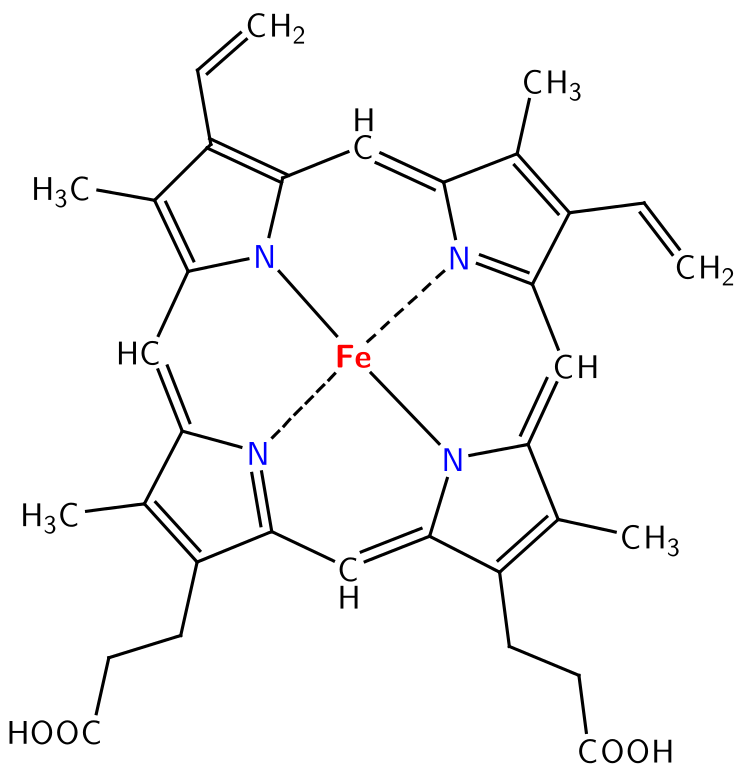
Ejemplos de ligandos polidentados
| Etilendiamina (H2N-CH2-CH2-NH2) | Ácido etilendiamintetracético (EDTA) | El anillo porfirínico del grupo hemo en la hemoglobina | Los éteres corona |
Ligandos ambidentados
Estos son ligandos que poseen dos o más átomos donantes pero cuya estructura no permite que ambos átomos se unan al mismo centro metálico simultáneamente. En estos casos, se pueden formar dos complejos diferentes con un mismo centro metálico dependiendo de cuál de los dos “lados” del ligando se une al metal. En estos casos, el mismo ligando recibe nombres distintos dependiendo de cuál de los átomos es el verdadero donante.
Ejemplos de ligandos ambidentados
| Ion cianuro o ligando ciano con el C como donante (–CN–) | Ion isocianuro o ligando isociano con el N como donante (–NC–) | Ion tiocianato o ligando tiociano con el S como donante (–SCN–) |
| Ion isotiocianato o ligando isotiociano con el N como donante (–NCS–) | Nitro con N como donante (–NO2–) | Nitrito con O como donante (–ONO–) |
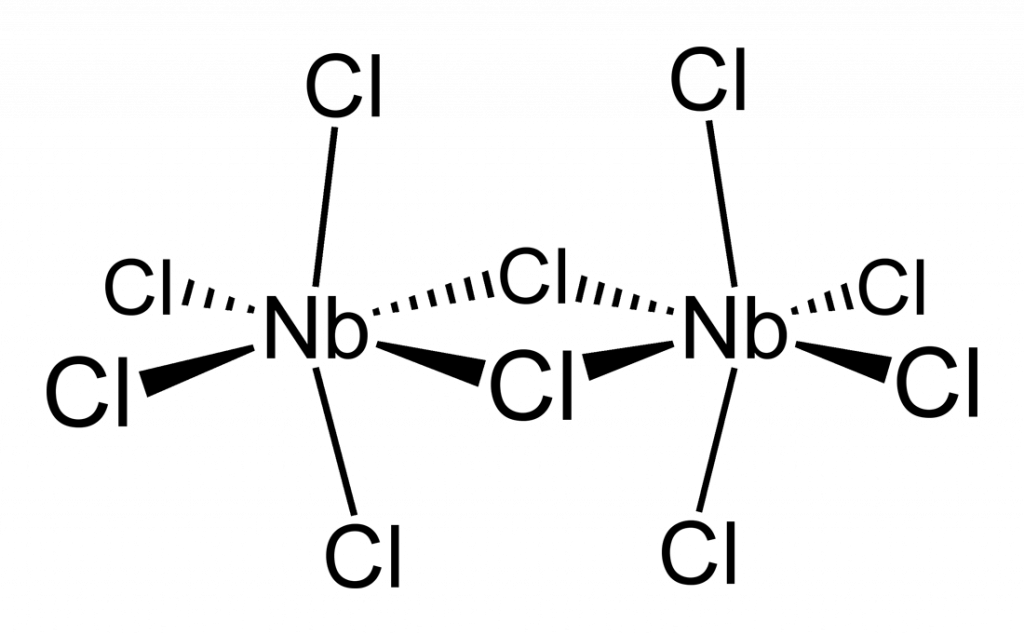
Ligandos puente
En último lugar, tenemos a los ligandos que pueden unirse simultáneamente a más de un centro metálico, bien sea por medio de dos átomos donantes separados, o a través del mismo átomo donante cuando este posee más de un par de electrones no compartidos. Este último caso es particularmente común en ligandos que poseen átomos de O, S o algún halógeno, o en los casos de los amiduros que poseen un nitrógeno negativo con dos pares de electrones libres.
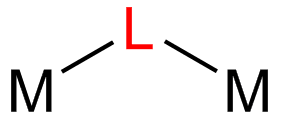
Al enlazarse simultáneamente a dos metales, estos ligandos forman un puente entre los dos centros y es de allí de donde proviene su nombre.
Ejemplos de ligandos puente
| Ion hidróxido (OH–) | Ion óxido (O22-) | Ion amido (NH22-) |
| Ion cianuro (CN–) | Monóxido de carbono o carbonilo (CO) | Ion cloruro (Cl–) |
Clasificación según el tipo de orbital atómico o molecular involucrado
Ligandos dadores σ (sigma)
Sos ligandos que solo poseen un par de electrones libres y lo ceden por medio de un enlace covalente σ. Generalmente estabilizan cationes con estados de oxidación bajos. Ejemplos de estos ligandos son el amoníaco y las aminas.
Ligandos dadores π (pi)
Estos ligandos se unen al centro metálico por medio de la nube electrónica π. Estos incluyen a las olefinas y los aromáticos.
Ligandos dadores σ y π
Son ligandos con elementos muy electronegativos y de alta densidad electrónica, es decir, son bases de Lewis duras. Al enlazarse con el centro metálico, son capaces de estabilizar estados de oxidación altos en los que el metal tiene todos o la mayoría de sus orbitales d vacíos lo que le permite al ligando cede densidad electrónica tanto por medio de enlaces π como σ. Ejemplos típicos son los halógenos.
Referencias
Alonso, D. (s. f.). Tipos de Ligandos y Complejos. Scribd. https://es.scribd.com/document/231066058/Tipos-de-Ligandos-y-Complejos
Chang, R. (2021). Quimica (11.a ed.). MCGRAW HILL EDDUCATION.
Cotton, A. F., & Wilkinson, G. (2006). Quimica inorganica avanzada/ Advanced Inorganic Chemistry (Tra ed.). Limusa.
Ligando puente. (s. f.). Hmong.es. https://hmong.es/wiki/Bridging_ligand
Ligandos – EcuRed. (s. f.). EcuRed. https://www.ecured.cu/Ligandos
Zaragoza, J. R. (2013). Guia II de prácticas de Química Inorgánica. niversidad Complutense de Madrid. http://147.96.70.122/Manual_de_Practicas_II/home.html?iv_6_complejos_compuestos_de_c.htm



