Tabla de Contenidos
La entalpía molar de fusión, a veces también llamada calor molar de fusión, es la variación de entalpía del cambio de fase de sólido a líquido de un mol de sustancia en su punto de fusión. En vista de que la variación de entalpía es equivalente al calor de un proceso llevado a cabo a presión constante, podemos también definir la entalpía molar de fusión como la cantidad de calor requerida para pasar un mol de sustancia desde el estado sólido al estado líquido en su punto de fusión y a presión constante.
Esta entalpía es una propiedad intensiva de la materia, por lo que depende únicamente de la composición de la misma, y no de la cantidad de la muestra con la que se esté trabajando ni de la extensión o tamaño del sistema. En otras palabras, es una propiedad característica de cada material y se refiere generalmente a sustancias puras.
Por ejemplo, la entalpía de fusión del agua a una presión de 1 atm es 6,02 kJ/mol, lo que quiere decir que se requieren 6,02 kJ para fundir o derretir 18 g de agua sólida o hielo (masa que corresponde a un mol de agua) que se encuentran a 0°C y así convertirlos en 18 g de agua líquida, también a 0°C.

Símbolo de la entalpía molar de fusión
Han existido a lo largo del tiempo distintas maneras de representar a las entalpías molares, incluyendo a la entalpía molar de fusión. El símbolo universalmente aceptado para la entalpía es H. Se trata de una función de estado definida por la diferencia entre la energía interna de un sistema y el producto PV; en otras palabras, H = U – PV. Sin embargo, cuando hablamos de la entalpía de un proceso como la fusión, y no de una sustancia, entonces en realidad nos referimos a un cambio de entalpía del sistema como consecuencia de dicho proceso. Por esta razón, en estos casos el símbolo de entalpía es en realidad ΔH.
Como se trata de la entalpía del proceso de fusión, se le agrega f o «fus» como subíndice, es decir ΔHfus (aunque f se utiliza poco ya que se puede confundir con la entalpía de formación, que es un concepto diferente). Finalmente, hay dos formas como se suele indicar que una entalpía es molar. Antiguamente se acostumbraba a colocar una barra encima del símbolo. Sin embargo, por distintas razones esta forma de representar cantidades termodinámicas molares resulta inadecuada, por lo que se reemplazó por la adición la letra m (de molar) como subíndice, separado del subíndice del proceso por una coma. Es decir que el símbolo actualmente aceptado para la entalpía molar de fusión es:

La entalpía molar de fusión estándar
Cuando la presión a la que se mide la entalpía molar es la presión estándar de 1 atm (o 1 bar, dependiendo de la convención que se utilice) y el proceso de cambio de fase ocurre en el punto de fusión normal (el cual corresponde al punto de fusión a la presión estándar), entonces se le denomina entalpía molar de fusión estándar lo que se indica añadiéndole al símbolo de la entalpía un 0 como exponente.

Unidades de la entalpía molar de fusión
Las unidades de la entalpía molar de fusión son [energía]/[mol] o, lo que es lo mismo, [energía].[mol]-1. Estas unidades dependen del sistema de unidades en el que se esté trabajando. A continuación, se presentan algunos ejemplos de unidades de uso común en distintos campos:
- Las unidades SI son J/mol o J.mol-1.
- kJ/mol o kJ.mol-1 (estas unidades son muy comunes dado el orden de magnitud de la mayoría de las entalpías molares de fusión).
- cal/mol o cal.mol-1.
- kcal/mol o kcal.mol-1 o, lo que es lo mismo Cal/mol o Cal.mol-1 (estas unidades son muy comunes dado el orden de magnitud de la mayoría de las entalpías molares de fusión).
- BTU/mol o BTU.mol-1 (utilizada con frecuencia en ingeniería).
La entalpía molar de fusión versus el calor latente de fusión
Es un error relativamente común confundir la entalpía molar de fusión con el calor latente de fusión. La razón es sencilla: ambos se refieren a la cantidad de calor necesaria para derretir o fundir una sustancia sólida, en ambos casos el cambio de fase ocurre a presión y temperatura constante, en ambos casos ocurre en el punto de fusión del sólido y ambas son propiedades intensivas de la materia. Sin embargo, no son lo mismo.
Para comenzar, el calor latente de fusión se representa con el símbolo Lfus o Lf. Sin embargo, hay una diferencia conceptual más importante relacionada con la cantidad de sustancia a la que se refiere cada término. Mientras que el calor molar de fusión hace referencia a 1 mol de sustancia, el calor latente de fusión representa la cantidad de calor requerida para fundir una unidad de masa de la sustancia, no un mol. Es decir que el calor latente es, en realidad, un calor específico de fusión, cuyas unidades en el SI son J/kg.
Determinación de la entalpía molar de fusión
Determinación experimental
Existen distintas maneras de determinar la entalpía molar de fusión de una sustancia. Experimentalmente se mide utilizando un calorímetro. Por ejemplo, si deseamos medir el calor molar de fusión del agua, podemos introducir una masa conocida de agua sólida (hielo) dentro de un calorímetro de capacidad calórica conocida y después dejar derretir los hielos mientras se controla la temperatura. Luego se puede determinar la cantidad de calor absorbida por los hielos para fundirse a partir del cambio de temperatura del calorímetro, que nos proporciona la cantidad de calor cedido por el mismo. Si estamos utilizando un calorímetro isobárico, es decir, de presión constante, este calor representa directamente la entalpía de fusión de la muestra (atención: es la entalpía de fusión ΔHfus, no la entalpía molar ΔHm,fus).
Finalmente, utilizando la masa de agua y su masa molar (18,02 g/mol), se determina el número de moles que había presentes en la muestra y se calcula la masa molar de fusión por medio de la siguiente ecuación:

Determinación a partir del calor latente de fusión
Como se mencionó antes, el calor latente de fusión es el calor por unidad de masa, en lugar de por mol. Por esta razón, el calor latente de fusión se puede transformar en el calor molar de fusión simplemente multiplicándolo por la masa molar de la sustancia:

Antes de llevar a cabo el cálculo, se debe verificar la consistencia de las unidades y llevar a cabo cualquier transformación que sea necesaria.
Determinación teórica
La entalpía molar de fusión también se puede calcular teóricamente a partir de otras cantidades termodinámicas. Por ejemplo, si conocemos los valores de las entalpías de formación estándar del sólido y del líquido, así como sus respectivas capacidades caloríficas a presión constante (Cp,m, s y CP, m, l, respectivamente).
En estos casos, se utiliza la Ley de Hess para establecer dos formas distintas de calcular la variación de entalpía de la fusión en condiciones estándar de temperatura y presión, uno directamente y otro llevando al sólido a su punto de fusión normal, llevando a cabo la fusión a dicha temperatura y luego llevando el líquido a la temperatura estándar a la que están reportadas las entalpías estándar de formación.
Es decir, se calcula la entalpía de los siguientes procesos:

Lo anterior representa el proceso en una sola etapa en el cual cierta cantidad de A pasa del estado sólido a la temperatura y presión estándar de T0 y P0, respectivamente, al estado líquido a la misma temperatura y presión. La entalpía de este proceso se puede calcular directamente a través de las entalpías de formación estándar de A en ambos estados.

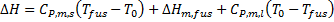
Este es el mismo proceso, solo que llevado a cabo por otro camino, llevando al sólido hasta el punto de fusión (Tfus), fundiéndolo a dicha temperatura, y luego llevando el líquido a la temperatura estándar T0.
Como ambos procesos comienzan y terminan en los mismos estados, entonces la Ley de Hess indica que las variaciones totales de entalpía deben ser iguales, por lo tanto:

De aquí, se resuelve la ecuación para hallar la entalpía molar de fusión, con lo que se obtiene:

Referencias
Atkins, P., & de Paula, J. (2010). Atkins. Química física (8.a ed.). Editorial Médica Panamericana.
Calor latente de fusión. (s. f.). Física con ordenador. http://www.sc.ehu.es/sbweb/fisica/estadistica/otros/fusion/fusion.htm
Chang, R. (2002). Fisicoquimica (1.a ed.). MCGRAW HILL EDDUCATION.
Entalpía de fusión. Educaplus (2021). http://www.educaplus.org/elementos-quimicos/propiedades/entalpia-fusion.html
Heat of Fusion. (2020, agosto 15). https://chem.libretexts.org/@go/page/1936
LearnChemE. (2020, 13 octubre). Calculate Heat of Reaction at an Elevated Temperature [Vídeo]. YouTube. https://www.youtube.com/watch?v=dxBD0j2gzjo&t=252s
Molar heat of fusion of ice. (2018, 5 abril). Nanopdf. https://nanopdf.com/download/molar-heat-of-fusion-of-ice-5aec35580aeb3_pdf



