Tabla de Contenidos
¿Qué es un enlace covalente?
Un enlace covalente es un tipo de enlace químico en el que dos átomos del mismo elemento o de elementos distintos comparten uno o más pares de electrones de valencia para así poder completar sus respectivos octetos. Este tipo de enlace es el que se da con mayor frecuencia entre los elementos no metálicos, pero en algunos casos también involucra a algunos metales de transición y metaloides.
Los enlaces covalentes son el tipo de unión o enlace químico que mantiene juntos a todos los átomos que forman moléculas como el agua, el dióxido de carbono y la glucosa, o sólidos moleculares tales como el grafito y el diamante, por nombrar algunos. Por otro lado, los enlaces covalentes son el tipo de enlace por excelencia presentes en los compuestos orgánicos que hacen que la vida sea posible, particularmente en las proteínas, aminoácidos, grasas y triglicéridos, carbohidratos, etc.
El concepto de enlace covalente es fácil de recordar si consideramos la palabra covalente como formada por las palabras “compartir” y ”valencia,” indicando que este tipo de enlace involucra casi exclusivamente los electrones ubicados en los orbitales de la capa de valencia de los elementos enlazados.
El enlace covalente es el tipo de enlace opuesto al enlace iónico, en el cual en lugar de compartir los electrones, uno de los átomos le quita los electrones al otro, adquiriendo el primero una carga eléctrica negativa mientras que el segundo queda con carga positiva. Estas especies se denominan iones (aniones los primeros y cationes los segundos) y se mantienen unidos por medio de la atracción electrostática que se da entre los iones de cargas opuestas.
Características de los enlaces covalentes
Los enlaces covalentes tienen varias características que los distinguen claramente de los enlaces iónicos y metálicos. Algunas de estas son:
- Se forman principalmente entre elementos no metálicos o entre elementos que tienen electronegatividades relativamente similares. De manera arbitraria se ha elegido una diferencia de electronegatividad igual o menor que 1,7 para definir un enlace como covalente.
- Los enlaces covalentes son, en promedio, más débiles que los enlaces iónicos. La energía requerida para romper un mol de un enlace covalente típico se encuentra por lo general en el rango de 150 a 400 kJ/mol, mientras que en el caso del enlace iónico, por lo general se requiere entre 600 y 4.000 kJ/mol e incluso más.
- Dan origen a los compuestos moleculares, los cuales generalmente poseen puntos de fusión y ebullición mucho menores que los compuestos iónicos (a excepción de los sólidos moleculares como el grafito y el diamante cuyos puntos de fusión son muy altos).
- Son direccionales, lo que quiere decir que, en los átomos que forman varios enlaces covalentes, estos se orientan preferentemente en ciertas direcciones, dando origen a geometrías moleculares características para cada sustancia molecular. Por ejemplo, en el caso del amoníaco (NH3), los tres enlaces covalentes con el hidrógeno se orientan a lo largo de las aristas de una pirámide de base trigonal, mientras que en el borano (BH3), los tres enlaces forman un triángulo equilátero, dando origen a una geometría plana trigonal.
- Los enlaces covalentes son más cortos que los enlaces iónicos. Mientras que en la mayoría de compuestos iónicos los núcleos se encuentran a una distancia de entre 160 y 370 pm, en el caso de los compuestos covalentes, esta distancia se encuentra entre aproximadamente 80 y 200 pm para la gran mayoría de enlaces covalentes simples, con solo algunas excepciones que se acercan a los 260 pm.
- La longitud de enlace decrece con el orden de enlace, lo que quiere decir que, para el mismo par de átomos, el enlace se hace más corto a medida que se comparten más electrones.
Tipos de enlaces covalentes
Los enlaces covalentes son muy comunes y también son muy variados, pudiendo clasificarse según diferentes criterios. A continuación, se presentan los criterios más importantes para la clasificación de los enlaces covalente y los tipos de enlaces incluido en cada uno de ellos.
Tipos de enlaces covalentes de acuerdo a la diferencia de electronegatividad
La diferencia de electronegatividad determina qué tan equitativamente se comparten los electrones cuando se forma un enlace covalente. En función de este criterio, podemos distinguir dos tipos de enlaces covalentes:
Enlaces covalentes polares
Se forman cuando se unen dos elementos cuya diferencia de electronegatividades se encuentra entre 0,4 y 1,7 (estos rangos son algo arbitrarios). En este tipo de enlaces, los electrones no se comparten de forma equitativa dado que el átomo más electronegativo retiene la nube electrónica más tiempo alrededor suyo que el menos electronegativo, adquiriendo el primero una carga parcial negativa mientras que el menos electronegativo adquiere una carga parcial positiva.
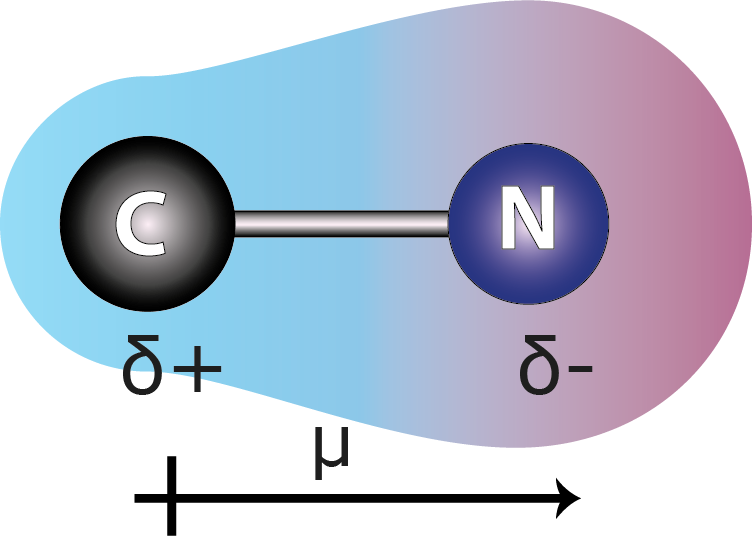
Esta separación de cargas se denomina dipolo eléctrico y es la razón por la que a este tipo de enlace se le denomina enlace polar. La separación de carga se mide a través del momento dipolar del enlace. Los compuestos que poseen enlaces polares pueden o no ser moléculas polares, dependiendo de si la sumatoria vectorial de todos los momentos dipolares da un momento dipolar neto resultante.
Enlaces covalentes apolares
Son los enlaces covalentes que se forman entre átomos que presentan una diferencia de electronegatividades menor que 0,4. En este tipo de enlaces se asume que no se forma un dipolo, por lo que se dice que el enlace no es polar.
Algunas personas reconocen una subclase de enlace covalente apolar al que denominan enlace covalente puro, el cual se da cuando se enlazan covalentemente dos átomos exactamente iguales del mismo elemento (además de ser del mismo elemento, ambos átomos también deben poseer la misma hibridación). Este es el enlace covalente perfecto en el que se comparten de manera completamente equitativa los electrones y podemos decir con certeza que el momento dipolar es cero.
Tipos de enlaces covalentes de acuerdo al solapamiento de orbitales atómicos (Teoría de Enlace Valencia)
La Teoría de Enlace Valencia establece que, para que se forme el enlace covalente, se deben solapar los orbitales atómicos de valencia de los dos átomos enlazados, de lo contrario, no podrán compartir los electrones. Según esta teoría, hay dos formas como estos orbitales pueden solaparse, dando origen a dos tipos de enlaces covalentes:
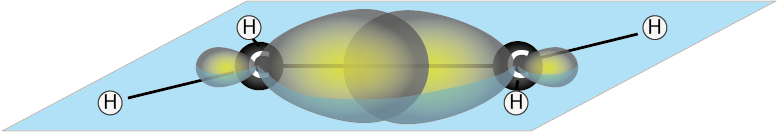
Enlaces σ (sigma)
El enlace sigma se forma por el solapamiento frontal de los lóbulos de los orbitales atómicos, razón por la que este enlace se forma a lo largo de la línea que une a los dos núcleos. Dos átomos enlazados solo pueden formar un enlace σ entre ellos debido a las restricciones relacionadas con las orientaciones de los orbitales atómicos, ya que si un orbital apunta en una dirección, los demás orbitales de la capa de valencia deberán obligatoriamente apuntar en una dirección diferente.
Enlaces π (pi)
Son los que se forman por solapamiento lateral de los orbitales atómicos, generalmente orbitales atómicos puros de tipo p o d. Estos enlaces solo se forman cuando dos átomos comparten más de un par de electrones, pudiendo formar más de un enlace pi.
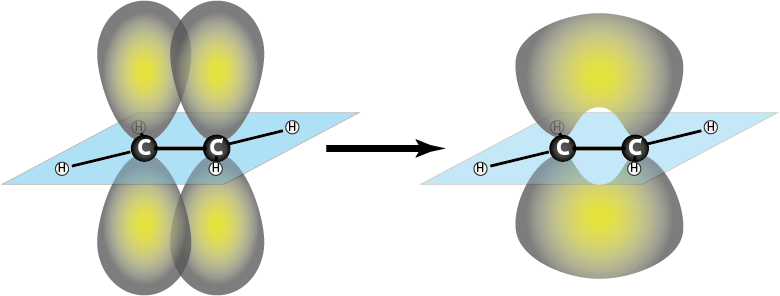
Los electrones que se comparten en los enlaces pi se encuentran ubicados por encima y por debajo o a los lados de la línea que une los dos núcleos, pero nunca pasan por dicha línea.
Tipos de enlaces covalentes de acuerdo al orden de enlace o número de pares electrones compartidos
Como se mencionó antes, en un enlace covalente, dos átomos pueden compartir uno o más pares de electrones. A este número de pares de electrones compartidos se le conoce como orden de enlaces. En función de este orden de enlace, los enlaces covalentes pueden clasificarse como:
Enlace covalente simple
Se da cuando dos átomos solo comparten un par de electrones. Los enlaces covalentes simples siempre son enlaces σ.
Enlace covalente doble
Es el enlace covalente en el que se comparten dos pares de electrones. Uno de los pares de electrones forma un enlace σ entre los dos núcleos, mientras que el segundo par forma un enlace π. Es importante comprender que, a pesar de que se denomina enlace doble y de que se considera como formado por un enlace σ y uno π, el enlace doble es en realidad un solo enlace.
Enlace covalente triple
Se forma cuando dos átomos comparten tres pares de electrones. En este caso, el enlace está compuesto por un enlace σ y dos enlaces π. Sin embargo, estos dos enlaces π forman un cilindro hueco donde se encuentran los cuatro electrones π mientras que los dos electrones σ se encuentran en el medio.
Otros tipos especiales de enlaces covalentes
Enlaces covalentes coordinados o dativos
En la mayoría de los enlaces covalentes, ambos átomos enlazados aportan un electrón para formar cada par de electrones enlazantes. Sin embargo, existe un tipo particular de enlace covalente bastante común que se forma como consecuencia de una reacción ácido-base de Lewis.
En estos casos, solo uno de los dos átomos aporta el par de electrones para formar el enlace covalente. A este tipo especial de enlace se le denomina enlace dativo (por razones obvias, ya que solo uno de los átomos le da o aporta los electrones necesarios para el enlace) o coordinado. Este es el tipo de enlace covalente que caracteriza a los compuestos de coordinación.
Enlaces covalentes de tres núcleos o tres centros
En algunas moléculas especiales se pueden formar enlaces covalentes en los que un mismo par de electrones se comparte entre más de dos átomos. Tal es el caso de los cationes alilo en los que un enlace covalente doble está conjugado con un carbocatión vecinal, formando un enlace π que abarca a los tres átomos permitiendo a los dos electrones π moverse libremente de un extremo al otro del enlace. Esto se le denomina deslocalización.
Ejemplos de enlaces covalentes comunes
Algunos ejemplos de enlaces covalentes son:
- C – H
- C – C
- C – N
- N – N
- N = N
- C = N
- C – O
- C = O
- O = O
- O – H
- Br – Br
- C – F
- C ≡ C
- N ≡ N
- C ≡ N
Referencias
Definicion.de. (s. f.). Definición de covalente. https://definicion.de/covalente/
Fernandes, A. Z. (2021, 10 mayo). Enlace covalente: características y tipos (con ejemplos). Toda Materia. https://www.todamateria.com/enlace-covalente/
Jhoanell, J. (2021, 18 noviembre). Enlace covalente. ConceptoABC. https://conceptoabc.com/enlace-covalente/
Libretexts. (2020, 30 octubre). 7.5: Fortaleza de los enlaces iónicos y covalentes. LibreTexts Español. https://espanol.libretexts.org/Quimica/Libro%3A_Quimica_General_(OpenSTAX)/07%3A_Enlace_Quimico_y_Geometria_Molecular/7.5%3A_Fortaleza_de_los_enlaces_ionicos_y_covalentes
Martín, M. (2020, 17 marzo). Cuando hablamos de enlaces covalentes nos referimos a un tipo específico de. Características. https://www.caracteristicas.pro/enlaces-covalentes/
Significados. (2020, 15 diciembre). Enlace covalente. https://www.significados.com/enlace-covalente/



