Tabla de Contenidos
Una ecuación molecular es un tipo de ecuación química utilizada para representar reacciones en las que intervienen compuestos iónicos, pero en la que dichos compuestos iónicos se representan por medio de su fórmula como si se tratara de moléculas neutras en lugar de iones de cargas opuestas.
Cuando equilibramos una ecuación molecular, tomamos en cuenta a todas las especies químicas que se encuentran presentes en el medio de reacción, aunque no participen directamente en la reacción en cuestión. De cierta forma, la ecuación molecular representa el extremo opuesto a la ecuación iónica neta, en la cual se representan únicamente los iones intervinientes en la reacción y no a los iones espectadores.
Importancia de la ecuación molecular
La ecuación molecular se caracteriza por representar a los reactivos y productos iónicos en la forma como se obtendrían si no se encontraran en disolución, es decir, en forma de sales iónicas neutras. En este sentido, estas ecuaciones resultan particularmente adecuadas para llevar a cabo cálculos estequiométricos relacionados con cantidades de reactivos y productos, reactivos limitantes y rendimientos de reacción; estos pueden ser más complicados en el caso de, por ejemplo, contar únicamente con la ecuación iónica neta.

El otro beneficio que trae contar con la ecuación molecular es que nos permite conocer en todo momento qué iones están presentes en el medio de reacción, además de los que están interviniendo activamente en la reacción que nos interesa. Esto es particularmente útil al momento de considerar posibles reacciones colaterales, tales como reacciones de óxido reducción o reacciones de precipitación, entre otras.
Limitaciones de las reacciones moleculares
A pesar de ser muy útil para los cálculos estequiométricos, la ecuación molecular no muestra de manera clara la forma real en la que ocurren las reacciones iónicas en disolución. Esto se debe a que la mayoría de los compuestos iónicos en las reacciones iónicas de disolución se encuentran disociados en sus iones constituyentes; incluso en los casos en los que esto no es así, son en realidad los iones libres los que realmente intervienen en la reacción, en vez de los iones espectadores, las especies sin disociar o los otros compuestos que puedan estar presentes.
Cómo representar a las reacciones químicas de compuestos iónicos
La ecuación molecular es solo una de tres posibles formas de representar a las ecuaciones químicas en las que están involucrados compuestos iónicos en disolución. Las otras dos formas son la ecuación iónica net antes mencionada y la ecuación iónica total.
Ecuación molecular versus ecuación iónica neta
La ecuación iónica neta es lo opuesto a una ecuación molecular. En esta se eliminan de la ecuación todas aquellas especies químicas neutras o iónicas que no intervengan directamente en la reacción de interés. Estas reacciones muestran de manera más clara cómo ocurre una reacción que involucra iones.
Ecuación molecular versus ecuación iónica total
La ecuación iónica total está a mitad de camino entre la ecuación iónica neta y la ecuación molecular. Esta muestra a las especies iónicas disociadas en sus iones constituyentes, pero las representa juntas en lugar de libres como realmente se encuentran en disolución.
Ajuste de las ecuaciones moleculares
Las ecuaciones moleculares se pueden ajustar o equilibrar de distintas maneras. Para empezar, por el hecho de representar a todas las especies como si fueran moléculas neutras, la ecuación molecular se puede equilibrar por tanteo sin necesidad de considerar la conservación de la carga, sino solo la conservación de la materia.
Sin embargo, el ajuste por tanteo en el caso de reacciones de óxido reducción muchas veces resulta difícil y ambiguo, por lo que es preferible recurrir a otros modos de ajuste, tales como el método algebraico (utilizando sistemas de ecuaciones). Sin embargo, la manera más común de ajustar ecuaciones moleculares es a partir de la ecuación iónica total o de la ecuación iónica neta.
En este último caso, el proceso implica añadir los contraiones adecuados a cada ion involucrado en la reacción para así obtener la ecuación iónica total; luego se unen los iones para formar los compuestos “moleculares” neutros.
Ejemplos de ecuaciones moleculares
A continuación, se muestran algunos ejemplos de ecuaciones moleculares de distintos tipos de reacciones químicas iónicas, junto con la respectiva ecuación iónica neta para así ilustrar las diferencias.
Ejemplo 1: Reacción ácido base entre el ácido sulfúrico y el hidróxido de sodio
La reacción molecular ajustada de la reacción entre el H2SO4 y el NaOH es:

Nótese que todas las especies se muestran asociadas, a pesar del hecho de que tanto el ácido sulfúrico como el hidróxido de sodio y el resultante sulfato de sodio son electrolitos fuertes que se encuentran disociados en el agua.
En contraposición a esta ecuación molecular, la ecuación iónica neta de esta misma reacción viene dada por:
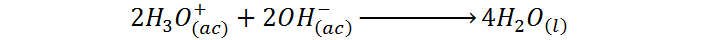
Como se puede ver, a pesar de que la primera ecuación pareciera sugerir que la reacción que está ocurriendo es la formación de una sal, lo que realmente ocurre es una reacción de neutralización entre la especie más ácida que se puede tener en disolución acuosa, los iones hidronio (H3O+) provenientes de la reacción entre el ácido sulfúrico y el agua, y los iones hidróxido (OH–) provenientes de la disociación del hidróxido de sodio.
Una manera alternativa de representar esta misma ecuación química es:
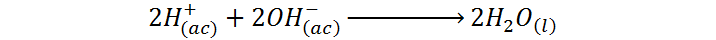
Ejemplo 2: Reacción redox entre permanganato de potasio y el yoduro de potasio en medio básico
Este es un ejemplo típico de una reacción química de óxido reducción que resulta complicada de ajustar por simple tanteo. La ecuación molecular ajustada en este caso es:
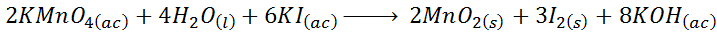
En cambio, la ecuación iónica neta para esta misma reacción viene dada por:

En este caso, cabe resaltar que el dióxido de manganeso es insoluble en agua, por lo que se forma como un sólido en los productos.
Ejemplo 3: Reacción de precipitación entre el nitrato de plata y el cloruro de sodio
Las reacciones de precipitación son algunas de las más simples de entender y de ajustar, tanto en forma de ecuación molecular como en forma de ecuación iónica neta. En el caso de la reacción entre el nitrato de plata y el cloruro de sodio, estos compuestos reaccionan para formar cloruro de plata el cual precipita por ser insoluble, y nitrato de sodio que permanece en disolución. La ecuación molecular es:

Por otro lado, la ecuación iónica neta resalta el hecho de que los que en realidad están reaccionando son únicamente los iones plata y cloruro, mientras que los iones sodio y nitrato no son más que espectadores:
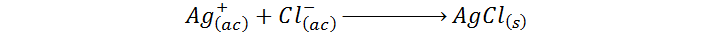
Referencias
Chang, R. (2021). Quimica (11.a ed.). MCGRAW HILL EDDUCATION.
Ecuación molecular (Química). (2017, 12 junio). Glosarios especializados. https://glosarios.servidor-alicante.com/quimica/ecuacion-molecular
Ecuaciones moleculares, iónicas completas e iónicas netas. Khan Academy. https://es.khanacademy.org/science/ap-chemistry-beta/x2eef969c74e0d802:chemical-reactions/x2eef969c74e0d802:net-ionic-equations/a/complete-ionic-and-net-ionic-equations



