Tabla de Contenidos
Una solución saturada es aquella que no admite la disolución de más soluto. En otras palabras, es una solución en la que ya se alcanzó la concentración máxima de soluto que se puede disolver en ese solvente particular y a una presión y temperatura particular. Se trata de soluciones en las que se ha establecido el equilibrio de solubilidad entre el soluto disuelto en el solvente y el soluto en estado sólido en el fondo del recipiente, en estado líquido bien sea encima o debajo del disolvente (dependiendo de las densidades) o en estado gaseoso.
El equilibrio de solubilidad
Como se acaba de mencionar, una solución está saturada cuando se alcanza el equilibrio de solubilidad. En el caso más simple, este equilibrio se puede representar por medio de la siguiente ecuación química:
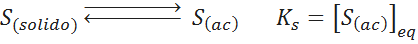
Donde S representa a un soluto molecular (que no se disocia) y los subíndices indican si se encuentra puro y en estado sólido, o si se encuentra disuelto (ac significa en disolución acuosa, aunque podría ser en cualquier otro solvente).
Cuando se tienen solventes moleculares como en este caso, para obtener una solución saturada y que se pueda establecer el equilibrio, se necesita que la concentración del soluto en la solución sea igual a la constante de equilibrio, Ks, y que aún quede algo del soluto en estado sólido sin disolver.
En el caso de solutos iónicos tal como las sales, la reacción general se ve así:

donde Kps es la constante del producto de solubilidad, [Mm+]eq representa la concentración molar del catión Mm+ en la solución saturada y [An-]eq representa la concentración molar de An- en la solución saturada.
En este caso, la condición que define a la solución saturada es que el producto de las concentraciones de los iones en solución (Mm+ y An-) elevados a sus respectivos coeficientes estequiométricos (n y m) debe ser igual a la constante del producto de solubilidad. Si el resultado es mayor que el Kps, la solución está sobresaturada y, si es menor, está insaturada.
El equilibrio de la solución saturada es dinámico
Cuando se logra obtener una solución saturada, pareciera que el soluto no se estuviera disolviendo más en el solvente y que el proceso de disolución se hubiera detenido. Sin embargo, esto no es exactamente así. De hecho, como sucede en la mayoría de los equilibrios químicos, el equilibrio de solubilidad no es un equilibrio estático sino dinámico, en el cual la reacción directa (la de disolución de más soluto) y la inversa (precipitación de soluto desde la solución) están ocurriendo a la misma velocidad. Por esta razón es que no se nota cambio alguno ni en la cantidad neta de soluto sólido, ni en la concentración del soluto en la solución.
Formas para obtener una solución saturada
Existen tres formas básicas de obtener soluciones saturadas:
- Añadir soluto hasta que no se disuelva más, sin importar cuán vigorosamente se agite la solución. Este es el método más sencillo, aunque a veces puede resultar muy tedioso ya que hay solutos que se disuelven muy lentamente.
- La segunda forma es partir de una solución insaturada y comenzar a evaporar el solvente. A medida que el volumen total de la solución disminuya sin pérdidas de soluto, la concentración del soluto irá incrementando, hasta que se alcance la concentración máxima (o solubilidad). En ese momento el soluto comenzará a precipitar y, de allí en adelante se tendrá una solución saturada.
- Otra forma es disolver una mayor cantidad de soluto del que el solvente puede soportar por medio del calentamiento. Al dejar enfriar esta solución, se obtendrá una solución sobresaturada. Por esta razón, cualquier perturbación, desde una vibración hasta sembrar un pequeño cristal en la superficie de la solución, inmediatamente desencadenará la precipitación del exceso de soluto. Esta precipitación cesará tan pronto se alcance el nivel de saturación.
Hay una cuarta forma de obtener soluciones saturadas a partir de soluciones insaturadas que consiste en modificar progresivamente el medio o el solvente para reducir la solubilidad del soluto. Esto se puede lograr añadiendo un solvente orgánico, cambiando el pH y de otras maneras también.
Factores que afectan el equilibrio de solubilidad y las soluciones saturadas
La naturaleza del soluto y del solvente
Cada compuesto químico tiene su solubilidad en cada tipo de solvente diferente. Por ejemplo, el azúcar es mucho más soluble que la sal en agua, así que siempre será más fácil saturar una solución con sal que con azúcar. También existen casos en los que es imposible obtener una solución saturada. Tal es el caso de los solutos que son miscibles con el solvente, como las soluciones de alcohol etílico y agua, los cuales se pueden mezclar en cualquier proporción.
La temperatura
Como se vio hace un momento, la temperatura juega un papel importante en las soluciones saturadas, ya que un aumento de temperatura puede aumentar la solubilidad del soluto, disolviendo todo el soluto sólido y convirtiendo una solución saturada en una insaturada.
Por otro lado, el efecto de la temperatura sobre la solubilidad de los gases es justamente el opuesto. En lugar de aumentar su solubilidad, las temperaturas altas la disminuyen. Como muestra de esto está el caso de las bebidas gaseosas. Estas pierden la mayor parte de sus gases al aumentar la temperatura.
El pH
En aquellos casos en los que el soluto tenga propiedades ácido-base, el pH puede jugar un papel muy importante para determinar su solubilidad. En general, cualquier reacción que ayude a ionizar más al soluto aumentará su solubilidad, lo que puede convertir una solución saturada en insaturada.
Por ejemplo, si el soluto es un ácido débil como el ácido benzoico y se tiene una solución saturada, añadir hidróxido de sodio que reacciones con dicho ácido y lo ionice ayudará a disolver una mayor cantidad de soluto en la solución.
La Presión
La presión afecta mayormente a los solutos gaseosos. Aumentar fuertemente la presión de los gases sobre una solución puede forzar al gas a disolverse en mayor cantidad en el solvente. Esto sería el equivalente a aumentar la temperatura para los solutos sólidos. En el caso de los gases, siempre que la solución y el gas estén confinados en un recipiente sellado, no importa cuánto sea la presión, la solución siempre terminará saturándose de gas si se le da suficiente tiempo.
Efecto del ion común
El ion común representa un efecto similar al del pH. Cuando se desea disolver un soluto iónico en una solución, éste se disociará y producirá cierta concentración de sus respectivos iones. Si tratamos de disolver el mismo soluto iónico en una solución que ya contiene algo de uno de sus iones, será más difícil disolverlo que si lo hiciéramos en el solvente puro. Esto es lo que se denomina el efecto del ion común y hace que sea más fácil saturar las soluciones.
Ejemplos de soluciones saturadas
Bebidas gaseosas selladas
Todas las bebidas gaseosas, sodas y cervezas carbonatadas son soluciones saturadas de dióxido de carbono en agua mientras la botella o lata esté completamente sellada.
En el momento en el que se destapa la botella, el equilibrio se pierde y la solución de repente se convierte en una solución sobresaturada, por lo que los gases comienzan a burbujear, escapándose.
El agua en las orillas del mar muerto
El mar muerto es uno de los lagos más salados en la tierra, y en la orilla se puede ver la cristalización de sal que proviene del agua del lago. Esto significa que, en algunas partes, el agua ha quedado atrapada en pequeños charcos que al evaporarse se saturan de sal y comienzan a precipitar.
Algunos tipos de miel
Existen algunos tipos de miel que son más concentradas que otras, y en algunos casos, son tan concentradas que las azúcares que contienen comienzan a cristalizar en la botella.
Esto demuestra que la solución estaba originalmente sobresaturada, y que, después de la cristalización, se tornó en una solución saturada.
Referencias
Brown, T. (2021). Quimica: La Ciencia Centra. (11ava ed.). Londres, Inglaterra: Pearson Education.
Chang, R., Manzo, Á. R., López, P. S., & Herranz, Z. R. (2020). Química (10ma ed.). New York City, NY: MCGRAW-HILL.
Flowers, P., Theopold, K., Langley, R., & Robinson, W. R. (2019). Chemistry 2e. Recuperado de https://openstax.org/books/chemistry-2e
Bubis, M. (1998). El Mar Muerto – Un Mar Insólito. Recuperado de http://sedici.unlp.edu.ar/bitstream/handle/10915/49306/Documento_completo.pdf
La miel y la temperatura (s.f.) Recuperado de https://www.latiendadelapicultor.com/blog/la-miel-y-la-temperatura/



