Tabla de Contenidos
Una solución ácida se puede definir simplemente como una solución acuosa en la que el soluto es un ácido. Las soluciones ácidas se caracterizan por las siguientes propiedades que permiten distinguirlas de las soluciones básicas y de las soluciones neutras:
- Generalmente tienen un sabor amargo, a veces picante.
- Son soluciones irritantes.
- Neutralizan a las bases.
- Son capaces de disolver a algunos metales.
A pesar de que muchas soluciones ácidas poseen todas estas características, otras solo poseen algunas, lo que hace que no sea una forma adecuada de definir a una solución ácida. Para desarrollar un concepto químico e inequívoco de solución ácida, debemos entender, en primer lugar, qué es un ácido desde el punto de vista químico.
El concepto de ácido
Existen tres conceptos de ácidos y bases diferentes que se han ido desarrollando a lo largo de la historia. El primero fue el concepto de ácidos y bases de Arrhenius, quien definió a un ácido como una sustancia capaz de liberar protones (H+) en solución; mientras, afirmó que una base era cualquier sustancia capaz de liberar iones hidróxido (OH–).
Luego, Brønsted y Lowry desarrollaron su propia teoría, modificando el concepto de base de Arrhenius, pero manteniendo el de ácido. Finalmente, el concepto actualmente aceptado de acidez es la capacidad de una sustancia deficiente de electrones de aceptar un par de electrones de parte de una base, para formar así un enlace covalente dativo.
A pesar de que el concepto de ácidos y bases de Lewis es el más amplio y el más preciso, su mayor aplicabilidad es al momento de analizar la acidez y basicidad fuera de los medios acuosos. Como una solución ácida es, por definición, una solución acuosa de un ácido, el concepto de Arrhenius o el de Brønsted y Lowry será más que suficiente para establecer un concepto más adecuado de solución ácida.
El equilibrio iónico del agua
La acidez de una solución acuosa es determinada por dos factores: el ácido que actúa como soluto, y el agua, que es el solvente. Entre los dos, el agua representa la parte más importante del concepto de acidez y basicidad. Esto es porque nuestra escala de medida de la acidez, la escala de pH, proviene del equilibrio iónico del agua, también denominado autoprotólisis del agua:
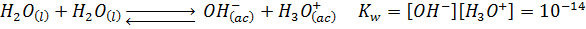
El agua es lo que consideramos una sustancia neutra. Por la estequiometría de la reacción anterior, sabemos el agua produce igual cantidad de iones hidronio e hidróxidos, lo que nos permite definir una solución neutra como aquella que, al igual que el agua, posee concentraciones equivalentes de estos dos iones.
Definición de solución ácida en función de las concentraciones relativas de iones hidronio e hidróxido
Al disolver un ácido que aporta una mayor cantidad de iones hidronio a la solución que los que provienen de la disociación del agua, el equilibrio iónico del agua se ve afectado y se desplaza hacia los reactantes, reduciendo la concentración de iones hidróxido en el proceso. Por esta razón, se obtiene una solución en la que hay más hidronios que hidróxidos. Esto permite establecer la siguiente definición:
Una solución ácida se define, desde el punto de vista químico, como cualquier solución acuosa que contenga una mayor concentración de iones hidronio que de iones hidróxido.
Definición de solución ácida en función de la concentración de iones hidronio
La constante de equilibrio de la ecuación anterior se puede utilizar para determinar las concentraciones en el equilibrio de los iones hidronio e hidróxido para cualquier solución. En el caso del agua pura o de cualquier solución neutra, como sabemos que ambas concentraciones son iguales, podemos escribir que:
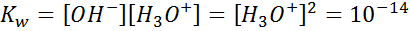
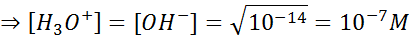
Cuando la concentración de iones hidronio en una solución aumenta, la concentración de iones hidróxido necesariamente disminuye para así mantener su producto igual a 10-14. Combinando este hecho con la definición anterior podemos establecer otra definición aún más precisa en términos únicamente de la concentración de iones hidronio:
Una solución ácida se define como cualquier solución acuosa que contenga una concentración de iones hidronio que sea mayor que 10-7 molar.
Esta definición contiene de manera implícita a la definición anterior, ya que, si la concentración de iones hidronio es mayor que 10-7, entonces la de iones hidróxido obligatoriamente deberá ser menor que 10-7 y, por ende, menor que la de los iones hidronio.
Definición de solución ácida en base a la escala de pH
Por último, podemos determinar cuándo estamos en presencia de una solución ácida, básica o neutra utilizando la escala de pH como medida de la acidez. El pH de una solución se define, para una solución ideal, como el negativo del logaritmo base 10 de la concentración molar de iones hidronio en una solución, es decir:
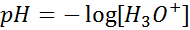
Para una solución neutra, cuya concentración de iones hidronio es de 10-7, el pH tiene un valor de 7. Además, debido al signo negativo, cuando aumenta la concentración de iones hidronio el pH en realidad disminuye. Por esta razón, para las soluciones ácidas en las que, sabemos, la concentración de iones hidronios es mayor que 10-7, el pH necesariamente será menor que 7. En consecuencia, podemos dar una cuarta definición de solución ácida:
Una solución ácida se define como cualquier solución acuosa cuyo pH sea menor que 7.
Esta última solución es a su vez la más sucinta, la más simple y, sin embargo, la que incluye de manera implícita a todas las demás definiciones que hemos presentado aquí. Si el pH es menor que 7, entonces la concentración de hidronios será mayor que 10-7, lo que implica que habrá una mayor concentración de iones hidronio que de iones hidróxido.
Referencias
- Assolea. (2020, 2 mayo). 7.6: La escala de pH. Recuperado de https://assolea.org/es/7-6-la-escala-de-ph/
- Brown, T. (2021). Química: La Ciencia Central (11ra ed.). Londres, Inglaterra: Pearson Education.
- Chang, R., Manzo, Á. R., López, P. S., & Herranz, Z. R. (2020). Química (10ma ed.). New York City, NY: MCGRAW-HILL.
- Flowers, P., Theopold, K., Langley, R., & Robinson, W. (2019a). 14.1 Brønsted-Lowry Acids and Bases – Chemistry 2e. Recuperado de https://openstax.org/books/chemistry-2e/pages/14-1-bronsted-lowry-acids-and-bases
- pH y pOH. (2020, 30 de octubre). Español LibreTexts. Recuperado de https://espanol.libretexts.org/@go/page/1911



