Tabla de Contenidos
La fenolftaleína es un compuesto orgánico ligeramente ácido de fórmula molecular C20H14O4, que es parcialmente soluble en agua. Sus disoluciones acuosas son completamente incoloras cuando el pH es neutro o ácido, pero presenta una coloración rosa intensa característica en disoluciones con un pH de 8,3 o mayor. Estas características hacen que la fenolftaleína sea una sustancia adecuada para usarse como indicador de pH en las titulaciones o valoraciones ácido-base de ácidos y bases fuertes, y de algunos ácidos débiles.
Estructura de la fenolftaleína
La fenolftaleína es un compuesto aromático fenólico que posee tres anillos bencénicos independientes, dos de los cuales poseen sendos grupos hidroxilo en posición para (convirtiéndolos en grupos fenólicos) y uno de los cuales está fusionado con una lactona de 5 miembros (un éster cíclico). La estructura se muestra en la siguiente figura:
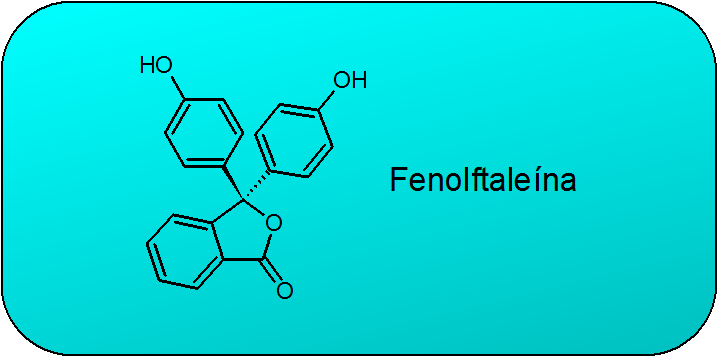
Esta estructura básica corresponde a un derivado del furano denominado isobenzofuranona, por lo que el nombre sistemático IUPAC de la fenolftaleína es 3,3-bis(4-hidroxifenil)isobenzofuran-1(3H)-ona.
Como todos los fenoles, los grupos hidroxilo enlazados a los anillos aromáticos son más ácidos que los grupos hidroxilo de los alcoholes y que los del agua, convirtiendo así a la fenolftaleína en un ácido diprótico débil. Como se verá más adelante, la pérdida de los protones de estos grupos hidroxilo produce algunos cambios en la estructura de la fenolftaleína que llevan al cambio de color observado en la base conjugada.
El punto de viraje de la fenolftaleína
Como todos los indicadores ácido-base de carácter ácido, que podemos representar con la fórmula genérica HIn, la fenolftaleína reacciona liberando un protón o cediéndolo a una base adecuada y convirtiéndose en el ion correspondiente a la base conjugada, In–. Se trata de una reacción de disociación ácida reversible que tiene asociada una constante de equilibrio o, en este caso, una constante de acidez de 10-9 (pKa = 9). La reacción es:
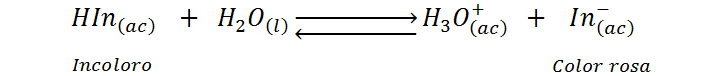
La constante de equilibrio de esta reacción viene dada por:
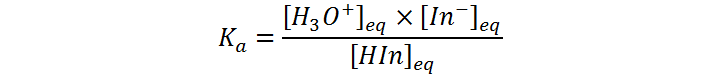
Esta ecuación se puede reordenar a:
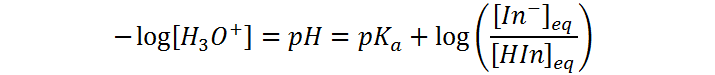
A las concentraciones típicas de los indicadores, el color generalmente es observable cuando la concentración de la fenolftaleína ionizada es alrededor de apenas la décima parte de la concentración de la especie protonada, y el cambio deja de ser observable cuando la especie ionizada tiene una concentración alrededor de 10 veces mayor que la de la especia neutra.
En otras palabras, el rango correspondiente al cambio de color se observa cuando la relación entre las concentraciones de In– y HIn pasa de aproximadamente 0,1 hasta 10, lo que implica que el pH cambia desde:
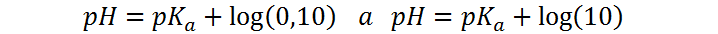
O, lo que es lo mismo:
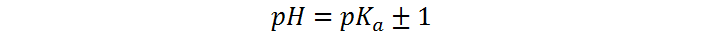
Dado que el pKa de la fenolftaleína es 9, lo anterior implica que el rango de pH para el viraje del color está entre 8 y 10, aunque en algunas referencias reducen el rango a 8,2 – 9,8.
A valores más extremos de pH, como por ejemplo cerca de 0 o de 14, ocurren reacciones ácido-base diferentes en las que se producen otros cambios de color. Sin embargo, lo extremos de estos valores de pH hace que estas reacciones sean poco útiles para la mayoría de las aplicaciones.
¿Por qué se da el cambio de color?
Las sustancias que poseen colores visibles generalmente tienen una parte de la molécula que es capaz de absorber luz visible. A dicha parte de la molécula se le denomina cromóforo. La mayoría de los compuestos químicos son capaces de absorber luz o radiación electromagnética alguna longitud de onda. Sin embargo, la mayoría de ellos solo son capaces de absorber luz ultravioleta de alta energía, ya que la diferencia de energía entre el orbital molecular ocupado de mayor energía (HOMO, por sus siglas en inglés) y el orbital molecular desocupado de menor energía (LUMO, por sus siglas en inglés) es muy alta.
Esto sucede, por ejemplo, en el caso de la fenolftaleína neutra. El hecho de ser incolora significa que deja pasar toda la luz visible, es decir, no la absorbe. En cambio, al ionizarse, se forma un sistema de enlaces dobles conjugados que contiene 16 electrones pi moviéndose libremente a lo largo de 15 centros atómicos a lo largo de dos de los tres anillos bencénicos de la molécula, como se puede observar en la siguiente ecuación (en la que se obvian algunas conversiones intermedias).
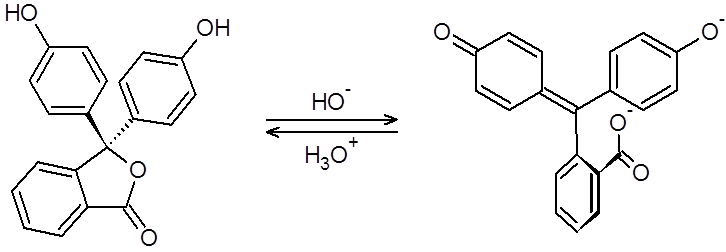
Esta conjugación de muchos enlaces dobles da paso a la formación de un mayor número de orbitales moleculares enlazantes y anitenlazantes que reduce la brecha energética entre los orbitales HOMO-LUMO, reduciendo así la energía que se requiere para excitar a un electrón en la molécula. Por lo tanto, se crean transiciones electrónicas que permiten al cromóforo absorber luz de una mayor longitud de onda.
En el caso de la fenolftaleína, al estar ionizada, esta absorbe intensamente luz de aproximadamente 550 nm, correspondiente a un color entre verde y amarillo. Como consecuencia, la disolución se ve del color complementario que está entre rosa y magenta.

Usos de la fenolftaleína
La fenolftaleína se conoce desde hace cientos de años por lo que posee muchas aplicaciones. Sin embargo, las más comunes son las que se indican a continuación:
Indicador del punto final en las titulaciones ácido-base
Gracias a su transición de color entre pH 8,2 y 9,8, la fenolftaleína es adecuada como indicador ácido-base en las siguientes titulaciones ácido-base:
- Titulaciones de ácidos fuertes con bases fuertes.
- Titulaciones de ácidos débiles con bases fuertes.
- Titulaciones de bases fuertes con ácidos fuertes.
Sin embargo, la fenolftaleína no resulta adecuada como indicador en las titulaciones de bases débiles con ácidos fuertes, ya que el rango de pH en el que se da el viraje de color de la fenolftaleína suele caer en la zona en la que se forma el buffer o tampón durante estas titulaciones, en lugar de darse cerca del punto de equivalencia.
Esto hace que el punto final con fenolftaleína de una titulación de base débil con ácido fuerte se alcance mucho antes del punto de equivalencia, produciendo así un error por defecto muy alto en la titulación.
Como indicador de pH en cultivos bacterianos
El difosfato de fenolftaleína se utiliza en microbiología como indicador de pH en algunos medios de cultivo selectivos para identificar a las bacterias positivas para fosfatasa ácida. En estos casos se utiliza en forma de un derivado denominado difosfato de fenolftaleína disuelto en un buffer alcalino. Si la bacteria expresa la fosfatasa ácida, esta hidroliza los grupos fosfato, liberándo la fenolftaleína y produciendo el viraje de color a rosado.
Reactivo de la prueba de Kastle-Meyer
La prueba de Kastle-Meyer es una prueba forense rápida y de fácil implementación que permite revelar la presencia de hemoglobina en una muestra y, por lo tanto, ayuda a confirmar si una muestra forense contiene sangre. Además de la hemoglobina, algunas otras sustancias tales como ciertos metales y algunos vegetales reaccionan con la fenolftaleína en la prueba de Kastle-Meyer, dando muchos falsos positivos, por lo que la prueba no se puede utilizar como definitiva de la presencia de sangre en una escena de crimen. Sin embargo, una prueba negativa sí descarta la presencia de hemoglobina, así que esta se suele utilizar como una primera prueba rápida que, de dar positiva, requiere la aplicación de una prueba más específica y selectiva.
En farmacología como laxante
Desde principios del siglo XX se sabe que la fenolftaleína es capaz de actuar como laxante catártico. Lo hace actuando sobre el sistema nervioso entérico donde estimula la producción de óxido nítrico, que evita que los intestinos reabsorban el agua, el sodio y los iones cloruro de las heces, facilitando así las evacuaciones. Sin embargo, este compuesto se ha dejado de utilizar como laxante por sus efectos colaterales indeseables, incluyendo incluso el cáncer y la pérdida de la función intestinal.
En medicina como agente diagnóstico
El color de la fenolftaleína en medio básico se utiliza como diagnóstico de la función renal, en particular en el estudio de orina residual en la vejiga. También es una causa común de orina roja en pacientes que consumen exceso de laxantes derivados de la fenolftaleína.
Referencias
Cantor B., D. A. (2018, 11 agosto). Fenolftaleína. Ciencia interactiva y divertida. https://cienciainteractivaydivertida.wordpress.com/2017/11/01/fenolftaleina/
Chang, R., Manzo, Á. R., López, P. S., & Herranz, Z. R. (2020). Química (10.a ed.). McGraw-Hill Education.
EcuRed. (s. f.). Fenolftaleína – EcuRed. Enciclopedia colaborativa en la red cubana. https://www.ecured.cu/Fenolftale%C3%ADna
Fenolftaleína. (s. f.-a). Laboratorium Discounter. https://www.laboratoriumdiscounter.nl/es/quimicos/a-z/f/fenolftaleina/
Fenolftaleína. (s. f.-b). Química.es. https://www.quimica.es/enciclopedia/Fenolftale%C3%ADna.html
Hanai, T. (2016). Quantitative Evaluation of Dissociation Mechanisms in Phenolphthalein and the Related Compounds. J. Comput. Chem. Jpn., 15,1. 13–21. https://www.researchgate.net/publication/301942181_Quantitative_Evaluation_of_Dissociation_Mechanisms_in_Phenolphthalein_and_the_Related_Compounds
Herrera C., D., Fernández P., C., Coria A., G. A., Manzo D., J., Aranda A., G. E., & Hernández A., M. E. (2015, 16 octubre). Laxantes con fenolftaleína y su relación con el desarrollo de cáncer. mediagraphic.com. https://www.medigraphic.com/pdfs/veracruzana/muv-2015/muv152f.pdf
Hornerov, M. (2015, 11 octubre). Prueba de Kastle-Meyer. FÍSICA Y QUÍMICA. https://cuadernofyq2015sp3e13.wordpress.com/2015/10/11/prueba-de-kastle-meyer/
Khan Academy. (2015). Conjugation and color. Khan Academy. https://www.khanacademy.org/science/organic-chemistry/spectroscopy-jay/uv-vis-spectroscopy/v/conjugation-and-color-1
Liceo AGB. (s. f.). INDICADORES VALORACIONES ÁCIDO-BASE. liceoagb.es. https://www.liceoagb.es/quimigen/acibas11.html
Restrepo V., C. A. (s. f.). Nefrología Básica 2 – Capítulo 2: Pruebas de laboratorio en nefrología. Asocolnef.com. http://asocolnef.com/wp-content/uploads/2018/03/Cap02.pdf



