Tabla de Contenidos
Una disolución no saturada o insaturada es una solución química en la que la concentración de soluto es menor que su solubilidad y, por lo tanto, aún puede disolver una mayor cantidad de este. En otras palabras, es una disolución que aún no está saturada de soluto, ya que la concentración del mismo no es suficiente para alcanzar el equilibrio de solubilidad.
Lo que determina cuándo se está en presencia de una solución insaturada o no es la concentración del soluto y una reacción química reversible conocida como equilibrio de solubilidad. Más adelante se explica en detalle la relación de los dos; pero primero, veamos qué caracteriza a las soluciones insaturadas.
Características de una solución insaturada
- En las soluciones insaturadas todo el soluto está disuelto en el disolvente, así que no queda ningún tipo de residuo. Son mezclas perfectamente homogéneas.
- Tienen una concentración menor que la solubilidad del soluto en respectivo disolvente. Por ejemplo, si la solubilidad de una sustancia pura A en un solvente, digamos agua, es de 0,5 gr/100 ml de solución, entonces una solución cuya concentración sea 0,4 gr/100 ml de solución será una solución insaturada.
- Aún pueden disolver más soluto. Al estar insaturadas, estas disoluciones todavía admiten una mayor cantidad de soluto. Esto es, por supuesto, hasta que la solución se sature.
- Pueden tener concentraciones muy variadas dependiendo del disolvente y del soluto. Por ejemplo, una disolución de azúcar en agua puede tener un porcentaje masa-volumen incluso de un 20 % m/v y aún no estar saturada, mientras que una solución de cloruro de plata (AgCl) insaturada debe tener una concentración menor que 1,8 mg/l (0,00018% m/v).
- Siempre que no cambien las condiciones, no cristalizarán ni formarán precipitados espontáneamente. Para hacerlo, una disolución debe estar sobresaturada.
Ejemplos de soluciones insaturadas
- El vinagre es una solución insaturada de ácido acético (CH3COOH) en agua.
- El ácido de batería es una solución insaturada de ácido sulfúrico (H2SO4) en agua.
- Muchos perfumes son soluciones insaturadas de compuestos aromáticos y aceites esenciales en alcohol.
- Los esmaltes transparentes para uñas son soluciones muy concentradas pero insaturadas de resinas plásticas en disolventes orgánicos como éteres y cetonas.
- El agua de mar es una solución insaturada de sales en agua.
- El plasma sanguíneo es una solución muy compleja con una gran cantidad de solutos a distintas concentraciones, pero es una disolución insaturada.
- Un almíbar ligero preparado disolviendo dos tazas de azúcar en un litro de agua es una disolución insaturada, a pesar de tener alta concentración de soluto.
El equilibrio de solubilidad y las disoluciones insaturadas
Como ya se mencionó antes, el principio químico detrás de las soluciones insaturadas es el equilibrio de solubilidad. Siempre que se disuelve un soluto en un disolvente, se da un proceso en el que las moléculas del disolvente desintegran el sólido separando las moléculas o los iones que lo componen para poder disolverlo. Este proceso es reversible, es decir, también se produce en la dirección contraria, llevando a la formación del sólido. Dependiendo de si el soluto es un compuesto molecular o un compuesto iónico, la reacción de disolución se puede representar de una de dos siguientes formas:
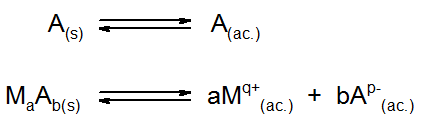
Aquí, A representan un soluto molecular cualquier como azúcar, y MaAb es un ejemplo de un soluto iónico cualquiera formado por a iones Mq+ y b iones Ap-, que podría ser AgCl, MgCl2 o cualquier otro. Se asumieron solutos sólidos, aunque A también podría ser un líquido o un gas. También se asumió al agua como solvente (ac. significa acuoso), aunque lo mismo aplica para cualquier otro disolvente.
Al ser reacciones reversibles, estas reacciones tienen asociadas una constante de equilibrio. En el caso de los compuestos iónicos, esta constante se denomina constante del producto de solubilidad y viene dada por:
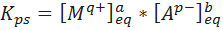
Donde Kps es la constante del producto de solubilidad, [Mq+] y [Ap-] representan las concentraciones molares en el equilibrio de los iones Mq+ y Ap-, respectivamente, y a y b son los coeficientes estequiométricos. En el caso de los solutos moleculares, la constante de equilibrio es simplemente la concentración molar del equilibrio para una solución saturada.
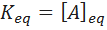
Definición de disolución insaturada en términos de la constante de equilibrio de solubilidad
La constante de solubilidad es la que determina cuándo estamos en presencia de una solución no saturada. Para una disolución cualquiera de un soluto iónico, al producto de la concentración de los iones elevados a sus coeficientes estequiométricos se le denomina cociente de reacción y se representa con Qps:

Para saber si se tiene una solución no saturada, basta con comparar el valor del Qps con el Kps del soluto en el disolvente y a la temperatura específica del caso. Solo cuando Qps es igual al Kps se puede decir que la disolución está saturada. Si es mayor que el Kps, la solución está sobresaturada, y cuando es menor que el Kps, es una solución insaturada. En resumen:


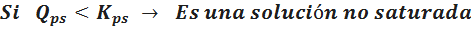
Para los solutos moleculares como el azúcar o un alcohol poco soluble en agua, lo único que cambia es que Q es simplemente la concentración molar del soluto en la solución. Todo lo demás es igual.
Niveles de saturación en las disoluciones
Como se pudo observar en la sección anterior, según la concentración del soluto o de su nivel de saturación, las disoluciones se pueden clasificar en:
- Disoluciones insaturadas. Son el tema principal de este artículo y son aquellas que aún admiten una mayor cantidad de soluto que la que ya poseen. Son homogéneas y no precipitan espontáneamente.
- Disoluciones saturadas. Son aquellas en las que ya se ha disuelto la cantidad máxima posible de soluto a una temperatura determinada. En estas disoluciones, el soluto puro en estado sólido, líquido o gaseoso se encuentra en equilibrio con el soluto en solución, por lo que se distinguen dos fases (son mezclas heterogéneas). A pesar de estar presente, la cantidad de soluto puro no cambia ya que el sistema está en equilibrio.
- Disoluciones sobresaturadas. Estas disoluciones tienen disuelta una cantidad de soluto mayor a la que permite el solvente. Por esta razón, representan un estado inestable en el cual el soluto se puede separar espontáneamente de la solución por medio de la cristalización o precipitación.
Disoluciones insaturadas y temperatura
Es importante tener en cuenta que cuando se habla de una disolución insaturada, se debe siempre especificar la temperatura. Esto se debe a que la solubilidad depende de la temperatura, por lo que una disolución que es insaturada a una temperatura, puede convertirse en saturada e incluso en sobresaturada si la temperatura cambia. En el caso de la mayoría de los solutos sólidos y líquidos, la solubilidad disminuye al aumentar la temperatura, y para los gases sucede lo contrario. Lo mismo también es cierto de las disoluciones saturadas y sobresaturadas. Si una disolución saturada o sobresaturada de un soluto sólido se calienta, la solubilidad puede aumentar hasta disolver todo el soluto presente y convertirla en una disolución insaturada.
Referencias
- Brown, T. (2021). Química: La Ciencia Central (11ra ed.). Londres, Inglaterra: Pearson Education.
- Chang, R., Manzo, Á. R., López, P. S., & Herranz, Z. R. (2020). Química (10ma ed.). New York City, NY: MCGRAW-HILL.
- La Solubilidad. (2020). Recuperado de https://espanol.libretexts.org/@go/page/1888
- Skoog, D. A., West, D. M., Holler, J., & Crouch, S. R. (2021). Fundamentos de Quimica Analitica (9th edition). Boston, Massachusetts: Cengage Learning. Types of Saturation. (2020). Recuperado de https://chem.libretexts.org/@go/page/1616



