Tabla de Contenidos
El calor de formación, también llamado entalpía de formación o entalpía de formación estándar, es la cantidad de calor asociado al proceso de formación de 1 mol de una sustancia química a partir de sus elementos constituyentes cuando estos se encuentran en su estado estándar, es decir, en su forma natural más estable a 25 °C. En este sentido, el calor de formación representa la diferencia de entalpía entre los productos y reactivos de una reacción química llevada a cabo a 25 °C en la cual el único producto es 1 mol de la sustancia de interés, mientras que el o los reactivos son los elementos que conforman a dicha sustancia en su estado natural más estable a dicha temperatura.
La entalpía de formación se representa con el símbolo ΔfH°X, donde la f indica que se trata de una entalpía de formación de la sustancia X (X corresponde a la fórmula química o el nombre de la sustancia que se forma) y el símbolo ° se utiliza para representar las condiciones estándar de reacción, en este caso T = 25 °C o 298,15 K.
Por ejemplo, el calor de formación del agua se representa como ΔfH°H2O y corresponde a la diferencia de entalpía de la siguiente reacción llevada a cabo a 25 °C:
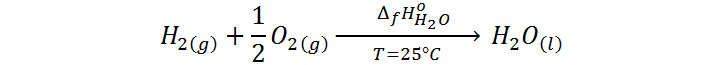
Nota sobre buenas prácticas: Antiguamente, se solía colocar la f de formación como subíndice de la H al representar a la entalpía o calor de formación (es decir, ΔHf°X). Sin embargo, conceptualmente esto es un error, ya que la entalpía (H) es una propiedad de la sustancia, no del proceso de formación de la sustancia, así que no debe llevar la letra f. En cambio, el símbolo Δ (delta) que representa una diferencia entre los estados final e inicial, sí se relaciona con el proceso de formación, por lo que en la actualidad se le coloca la f como subíndice al mismo.
Reacciones de formación
La anterior es un ejemplo de una reacción de formación (la reacción de formación del agua). Los detalles importantes a tomar en cuenta para reconocer una reacción de formación son:
- Solo debe haber un producto (en este caso H2O).
- El coeficiente estequiométrico del producto debe ser 1.
- Los reactivos deben ser todos sustancias elementales (en este caso hidrógeno y oxígeno), no compuestos.
- El alótropo de cada reactivo presente debe corresponder al alótropo más estable en condiciones estándar (en el caso del elemento hidrógeno, es el hidrógeno molecular gaseoso, y en el caso del oxígeno, es el oxígeno molecular gaseoso).
Elementos en estado estándar
Algunos ejemplos de elementos en sus respectivos estados naturales más estables en condiciones estándar son:
| Elemento | Forma más estable en condiciones estándar | Elemento | Forma más estable en condiciones estándar |
| Hidrógeno | H2(g) | Oxígeno | O2(g) |
| Nitrógeno | N2(g) | Flúor | F2(g) |
| Cloro | Cl2(g) | Bromo | Br2(l) |
| Yodo | I2(s) | Mercurio | Hg(l) |
| Carbono | C(s, graffito) | Azufre | S(s, rómbico) |
| Plata | Ag(s) | Hierro | Fe(s) |
¿Qué es la entalpía?
La entalpía es una función de estado que caracteriza a un sistema como por ejemplo un compuesto químico, un gas a presión dentro de un pistón, o incluso un planeta orbitando alrededor de una estrella. Esta propiedad se representa con el símbolo H (que proviene de la palabra calor en inglés, heat) y, desde el punto de vista termodinámico, se define como la suma entre la energía interna de un sistema (U) y el producto de su presión y su volumen (producto PV). Es decir:
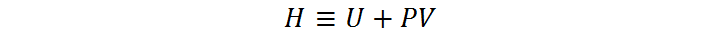
A excepción de sistemas muy sencillo como por ejemplo los gases ideales, la entalpía absoluta (H) no se puede medir experimentalmente ni calcular de manera sencilla. Esto se debe a que, para sistemas relativamente complejos, la determinación de la energía interna (U) resulta inmensamente compleja de determinar, ya que se deben considerar demasiadas variables que provienen de las interacciones entre las partículas que forman el sistema.
Sin embargo, como se verá en la siguiente sección, sí se puede medir experimentalmente la variación de entalpía durante distintos procesos, lo cual permite establecer valores relativos de entalpía, en los que las entalpías de formación juegan un papel esencial.
¿Es calor de reacción o entalpía de reacción?
Debido a la definición termodinámica de la entalpía (H=U+PV), se puede demostrar matemáticamente que la variación de entalpía (ΔH) de un proceso llevado a cabo a presión constante, es igual al calor liberado o absorbido por el sistema durante dicho proceso. Es decir, en general:
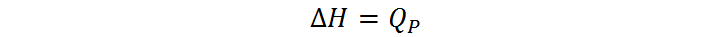
donde QP representa calor a presión constante. Esto quiere decir que, a pesar de que no podemos medir H, sí podemos medir ΔH, ya que el calor se puede medir. Algo similar sucede con el potencial eléctrico o voltaje, V, el cual no podemos medir directamente con un voltímetro, pero sí podemos medir la diferencia de voltaje, ΔV. Esto abre la posibilidad de establecer una escala relativa de entalpía, siempre que encontremos o definamos un sistema de referencia al cual le asociemos el valor de cero.
En el caso del voltaje, el cero suele ser el voltaje de tierra. En el caso de la entalpía, el cero consiste en los elementos puros en su estado estándar o forma alotrópica natural más estable a 25 °C.
Tip del experto: la manera correcta de referirse a la entalpía de un proceso como una reacción de formación debería ser “variación de entalpía” ya que se trata de un ΔH. Esto permitiría distinguirla de la entalpía absoluta o H. Sin embargo, dado que la reacción de formación es evidentemente un proceso de cambio de un estado inicial a uno final, la palabra “variación” se sobreentiende. Entonces, siempre que se hable de entalpía de un proceso, se está hablando de un valor de ΔH, mientras que, cuando se habla de la entalpía de un sistema como una sustancia pura en un estado particular, se refiere a una entalpía absoluta (H).
Unidades del calor de formación
Dado que la entalpía es una suma entre energía y el producto PV, y además, la diferencia de entalpía representa también un calor a presión constante, las unidades del calor de formación son unidades de energía sobre mol ([Energía]/mol o [Energía].mol-1). En la mayoría de los casos, las unidades son kJ.mol-1, pero en algunos casos se utilizan kcal.mol-1 también.
¿Cómo se mide el calor de formación?
El calor de formación de una sustancia química por lo general no se mide directamente ya que, en la gran mayoría de los casos, no es posible llevar a cabo la reacción de formación. Solo un puñado de reacciones de formación se pueden llevar a cabo en el laboratorio, como por ejemplo la formación del agua por combustión de hidrógeno gaseoso, o la formación de dióxido de carbono por la combustión de carbono grafito.
Sin embargo, no es posible producir un compuesto químico como el benceno a partir de carbono grafito e hidrógeno de manera directa. La solución a este problema se encuentra en la Ley de Hess. Lo que se hace en su lugar es que se mide el calor de una reacción en la que la sustancia esté involucrada y que involucre también sustancias cuyas entalpías de formación sí conozcamos. Un ejemplo muy común es utilizar reacciones de combustión, ya que la entalpía de formación del oxígeno por definición es cero, y las del agua y el dióxido de carbono sí se pueden medir directamente, como acabamos de explicar.
Ejemplo:
Supongamos que queremos determinar el calor de formación del benceno (C6H6). En este caso, llevaríamos a cabo la combustión del benceno cuya ecuación química se presenta a continuación, y mediríamos la entalpía de la reacción:
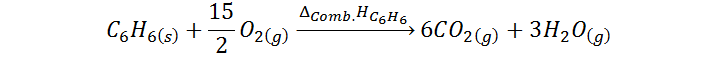
Luego, utilizando la Ley de Hess, y los calores de formación del CO2 y el H2O, el calor de formación del benceno resulta ser:
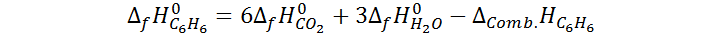
Pero, ¿cómo se mide la entalpía de reacciones como la combustión? Se hace mediante una técnica denominada calorimetría.
La calorimetría
Las entalpías de reacción se miden por medio de la calorimetría. Esta técnica consiste en llevar a cabo una reacción química dentro de un calorímetro de capacidad calorífica total conocida (CCal), para luego medir el cambio en la temperatura del calorímetro debido al calor liberado o absorbido por la reacción (ΔT = Tf – Ti). Este cambio de temperatura se utiliza para calcular la cantidad de calor liberada o absorbida por el calorímetro (que es el negativo del calor absorbido o cedido por la reacción) por medio de la siguiente ecuación:
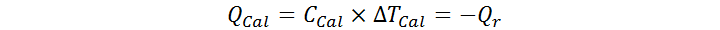
Existen dos tipos principales de calorímetros, aquellos que funcionan a presión constante y los que funcionan a volumen constante. En el caso de la calorimetría a presión constante, el calor calculado según la ecuación anterior mide directamente la entalpía de reacción (Qr = ΔrH° = – QCal, recordemos que la entalpía de un proceso a presión constante es igual al calor de dicho proceso). Sin embargo, esta técnica no siempre es fácil de implementar.
Los calorímetros a volumen constante son más comunes y fáciles de operar. La siguiente figura muestra un esquema de un calorímetro a volumen constante típico indicando sus partes.
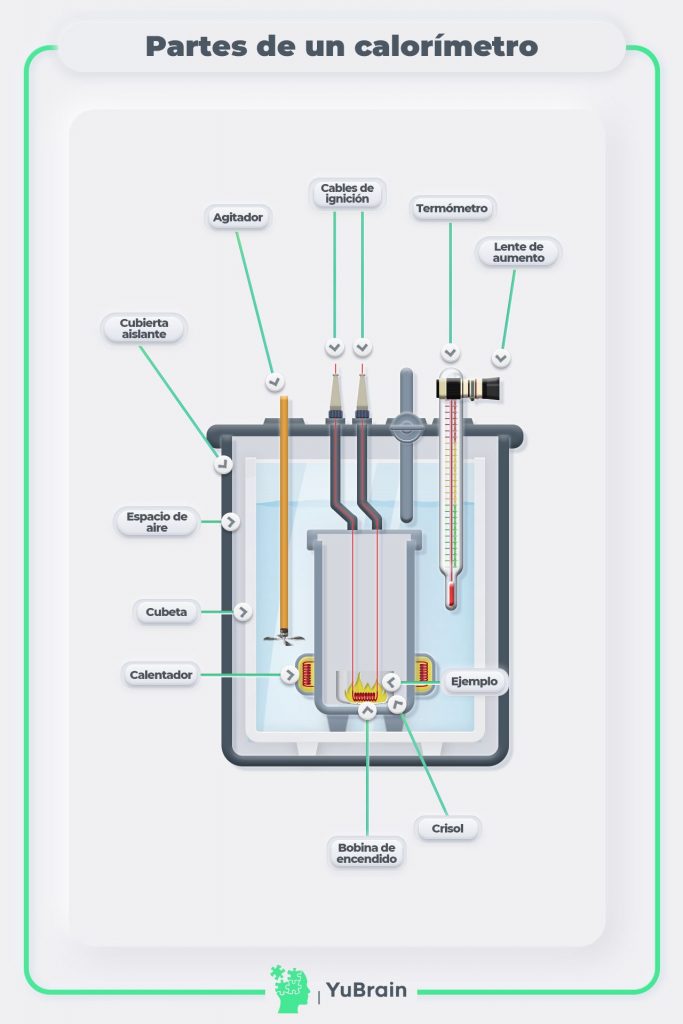
El calor medido en la calorimetría a volumen constante representa la variación de energía interna del sistema debida a la reacción, no la entalpía. Sin embargo, esta está relacionada con la entalpía de la reacción por medio de la siguiente ecuación:
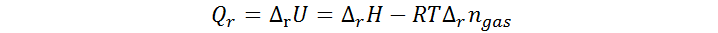
Donde Δrngas representa la variación en el número de moles de gases entre los productos y los reactivos de la reacción química involucrada. De esta ecuación se obtiene la entalpía de reacción como sigue:
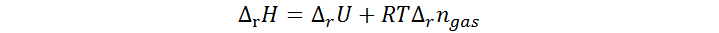
¿Para qué sirve la entalpía de formación o calor de formación?
#1 Sirve para determinar entalpías de reacción.
La entalpía cumple la Ley de Hess, que es una forma de expresar el hecho de que la entalpía es una función de estado. Esta ley reza que “cuando durante una reacción química los reactivos se convierten en productos, la variación de entalpía es la misma independientemente de que la reacción se lleve a cabo en un solo paso o en múltiples pasos.” En otras palabras, la ley de Hess establece que el cambio de entalpía es independiente del camino que se recorre para llegar desde los reactivos a los productos.
Una consecuencia de la Ley de Hess, es que, dado que podemos escribir reacciones de formación para cualquier compuesto que exista, y dado que podemos manipular las reacciones de formación a nuestro antojo, siempre y cuando los cambios se reflejen en la entalpía de las reacciones modificadas, podemos escribir la entalpía de cualquier reacción química en función de las entalpías de formación de los reactivos y productos involucrados en la reacción. En forma general, podemos escribir que, para una reacción genérica como la siguiente:

la entalpía de reacción (ΔrH°) viene dada por
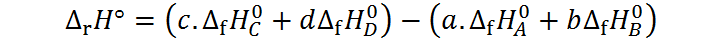
O, de manera más general:
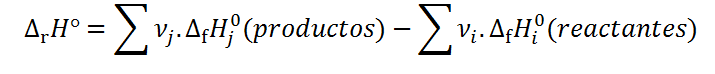
Donde νj y νi representan los coeficientes estequiométricos de cada producto y reactante, respectivamente y ΔfHj° y ΔfHi° representan los calores de formación de cada producto y reactivo, respectivamente.
#2 Representan el valor de la entalpía relativa de las sustancias químicas en su estado estándar.
Como mencionamos anteriormente, los elementos puros en su estado estándar o forma alotrópica natural más estable a 25 °C representan el punto de referencia para la determinación de la escala relativa de entalpía. Eso se debe a que, dada la definición de las reacciones de formación, la entalpía de formación de los elementos puros en su estado natural más estable debe ser cero, ya que su reacción de formación tendría el mismo reactivo y el mismo producto (sería una reacción nula).
Como esta reacción de formación en realidad no implica ningún cambio de estado, entonces la entalpía de esta reacción, que es igual a la entalpía final menos la entalpía inicial, debe ser cero, porque ambos estados son iguales.
Por ejemplo, la reacción de formación del oxígeno gaseoso a 25°C viene dada por:

Luego, la entalpía de esta reacción, que debe ser igual a la entalpía de formación del oxígeno, vendría dada por:
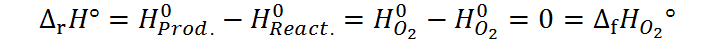
Esto nos permite medir las entalpías de reacción como vimos antes.
Siguiendo un razonamiento similar, podemos también definir la entalpía absoluta de los elementos en su estado natural más estable como cero, y al hacerlo, las entalpías de formación de las distintas sustancias (ΔfHX°) se convierten en entalpías relativas de las sustancias en condiciones estándar (HX°).
Por ejemplo, para el caso de la formación del agua presentado anteriormente:
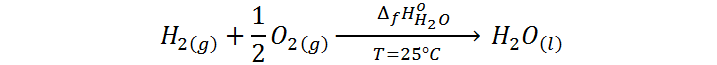
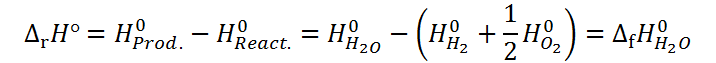
Si definimos las entalpías del hidrógeno y del oxígeno como cero, entonces obtenemos que la entalpía de formación del agua es igual a la entalpía estándar del agua en esta escala relativa:
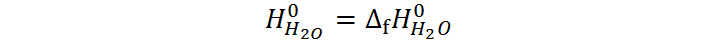
Esta entalpía es muy importante ya que, por medio del cálculo o medición de variaciones de entalpía, podemos transformar estas entalpías relativas que están en condiciones estándar, en entalpías relativas en cualquier otro conjunto de condiciones (a otras temperaturas u otras presiones, por ejemplo). Esto es particularmente útil para estudiar los intercambios de energía de reacciones químicas y de cambios de fase en condiciones no estandarizadas, por lo que es común conseguir tablas de entalpías de sustancias de uso común como el agua y otros solventes, sustancias combustibles y otras sustancias químicas a distintas temperaturas y presiones, todas calculadas a partir de las entalpías de formación.
Referencias
Atkins, P., & de Paula, J. (2010). Atkins. Química física (8.a ed.). Editorial Médica Panamericana.
Byjus. (2021, 22 marzo). Measurement of enthalpy change. https://byjus.com/chemistry/measurement-of-enthalpy-and-internal-energy-change/
Chang, R. (2012). Química (11.a ed.). McGraw-Hill Education.
Editors of the Encyclopaedia Britannica. (2020, 9 abril). Enthalpy | Definition, Equation, & Units. Encyclopedia Britannica. https://www.britannica.com/science/enthalpy
Planas, O. (2019, 25 septiembre). ¿Qué es la entalpía? Solar-Energía. https://solar-energia.net/termodinamica/propiedades-termodinamicas/entalpia
Universidad Tecnológica Nacional. (s. f.). DIAGRAMAS DE ENTALPIA COMPOSICION. https://www.frro.utn.edu.ar/repositorio/catedras/quimica/3_anio/integracion3/diagramas_de_entalpia_composicion.pdf



