Tabla de Contenidos
Una base conjugada es la especie química que se forma luego de que una molécula de un ácido se neutraliza, bien sea por la pérdida de un protón o al recibir un par de electrones desapareados de parte de una base de Lewis. En otras palabras, es el producto de una reacción de neutralización ácido base que proviene directamente del ácido original. Al ácido y a su base conjugada se les denomina, en conjunto, par ácido-base conjugados.
Consideremos la siguiente reacción de disociación de un ácido débil de Brønsted-Lowry:
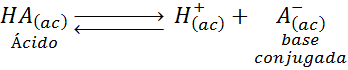
En este caso, el ácido es el reactivo de la izquierda, HA, mientras que del lado derecho se encuentran el protón liberado por el ácido y el anión, A–, que quedó luego de que el ácido perdiera su protón.
La razón por la que se le dice “base” conjugada es porque todas las reacciones ácido-base son reversibles, aun aquellas que involucran ácidos y bases fuertes (solo que sus constantes de equilibrio son muy grandes y los equilibrios están muy desplazados hacia los productos). Por esta razón, lo que en un sentido representa la ionización de un ácido como en la ecuación anterior, en el sentido contrario representa la protonación de una base, en este caso, el anión A–.
Cómo reconocer una base conjugada
Desde el punto de vista del concepto de ácidos y bases de Brønsted-Lowry, un ácido es cualquier sustancia que al disolverse en agua es capaz de ionizarse y de ceder un protón. Como, al hacerlo, se convierte en su base conjugada, la única diferencia entre un ácido y su base conjugada es la ausencia de un protón.
Además de esto, debido a que el protón es positivo y se lleva su carba consigo, la base conjugada siempre termina con una carga eléctrica menor por una unidad que el respectivo ácido. Esto quiere decir que, si el ácido era neutro, entonces su base conjugada será negativa (con carga -1), mientras que, si el ácido es positivo, entonces la base conjugada será neutra y así sucesivamente.
Bases conjugadas de ácidos polipróticos
Reconocer la base conjugada de un ácido monoprótico suele ser sencillo, sin embargo, en los casos de los ácidos polipróticos, puede surgir algo de confusión. Esto sucede porque a veces escribimos las reacciones de disociación de ácidos como el H2SO4 como si perdieran ambos protones en una sola etapa. Sin embargo, esto no es lo que ocurre en realidad.
Todos los ácidos poliprótocos sufren reacciones sucesivas de ionización y en cada reacción se convierten en una base conjugada diferente. La confusión surge del hecho de que la primera base conjugada de un ácido poliprótico aún conserva protones, así que, además de bases conjugadas, también son ácidos que tienen su propia base conjugada.
El siguiente ejemplo ilustrará esto de forma más clara:
Ejemplo de ácidos polipróticos y sus bases conjugadas: el ácido fosfórico
Quizás uno de los mejores ejemplos para ilustrar los equilibrios de un ácido poliprótico sea el ácido fosfórico o H3PO4. Este ácido puede perder, en total, tres protones según las siguientes reacciones reversibles de disociación:
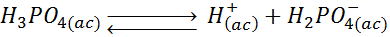
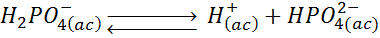
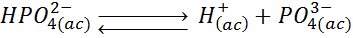
En este caso, el ácido fosfórico (H3PO4) se convierte en el ion dihidrógeno fosfato (H2PO4–) tras perder un protón, por lo que este es su base conjugada. Al mismo tiempo, el H2PO4– es un ácido que se ioniza en la segunda reacción para convertirse en el ion hidrógeno fosfato (HPO42-), así que este último es la base conjugada del H2PO4–, pero no del H3PO4. Lo mismo sucede con el ion HPO42-, el cual también es un ácido (además de ser la base conjugada del H2PO4–). Al disociarse, se convierte en el ion fosfato, el cual es su base conjugada.
Relación de la base conjugada con la acidez del ácido
La estructura de base conjugada puede dar pistas acerca de la acidez de cualquier ácido. Analizar la estabilidad de dicha especie química y compararla con la estabilidad estructural del ácido original ayuda a explicar por qué algunos ácidos son más fuertes que otros.
Entre los criterios de estabilidad que se pueden aplicar al análisis de la estructura tanto del ácido como de su base conjugada están:
- Octetos llenos: la teoría de enlace de Lewis indica que las moléculas que poseen átomos que violen la regla del octeto son menos estables que aquellas en las que todos los átomos poseen sus octetos llenos.
- Estructuras de resonancia: las moléculas con más estructuras de resonancia son más estables que las que tienen menos.
- Aromaticidad: las especies que presentan aromaticidad tienden a ser mucho más estables que aquellas que no son aromáticas, y estas son más estables que las que son antiaromáticas.
- Menor carga total: en general, las especies neutras tienden a ser más estables que las especies iónicas, y, al comparar iones, los que tienen menos carga neta suelen ser más estables que los que tienen más.
- Separación de cargas: al comparar dos estructuras con la misma carga neta, aquella que tenga un menor número de cargas formales separadas entre varios átomos son más estables que las que tienen más cargas formales.
- Ubicación de las cargas formales: entre dos moléculas que tengan las mismas cargas formales, será más estable la que posea las cargas negativas sobre los átomos más electronegativos y las positivas sobre los átomos menos electronegativos.
Comparar al ácido con su base conjugada en función de estos criterios de estabilidad permite determinar si el ácido preferirá encontrarse en su forma protonada (como HA, por ejemplo) o ionizada (como A–, por ejemplo).
Si la base conjugada es más estable que el ácido, entonces el ácido tenderá a disociarse y será más fuerte, mientras que, si sucede lo contrario, será un ácido débil.
Ejemplos de pares ácido: base conjugada
A continuación, se presentan algunos ejemplos adicionales de diferentes ácidos y sus respectivas bases conjugadas:
- El ácido clorhídrico y el anión cloruro (HCl y Cl–)
- El anión bicarbonato y el anión carbonato (HCO3– y CO32-)
- El catión amonio y el amoníaco (NH4+ y el NH3)
- El ácido sulfúrico y el bisulfato (H2SO4 y el HSO4–)
Referencias
- Assolea. (2020, 2 mayo). 7.6: La escala de pH. Recuperado de https://assolea.org/es/7-6-la-escala-de-ph/
- Brown, T. (2021). Química: La Ciencia Central (11ra ed.). Londres, Inglaterra: Pearson Education.
- Chang, R., Manzo, Á. R., López, P. S., & Herranz, Z. R. (2020). Química (10ma ed.). New York City, NY: MCGRAW-HILL.
- Flowers, P., Theopold, K., Langley, R., & Robinson, W. (2019a). 14.1 Brønsted-Lowry Acids and Bases – Chemistry 2e. Recuperado de https://openstax.org/books/chemistry-2e/pages/14-1-bronsted-lowry-acids-and-bases
- pH y pOH. (2020, 30 de octubre). Recuperado de https://espanol.libretexts.org/@go/page/1911



