Tabla de Contenidos
Un ácido diprótico es un ácido de Brønsted y Lowry que posee dos átomos de hidrógeno ionizables. Es decir, se trata de un ácido capaz de ceder dos protones al disolverse en agua o al reaccionar con dos moléculas de una base; de allí su nombre. De hecho, di- es un prefijo que significa 2, mientras que prótico hace referencia al protón, en otras palabras, al catión que forma el átomo de hidrógeno al perder su único electrón.
Los ácidos dipróticos pueden ser tanto fuertes como débiles, aunque la gran mayoría son ácidos débiles. Incluso en los pocos casos en los que son fuertes, tales como en el ácido sulfúrico, solo la primera disociación es fuerte, mientras que la segunda disociación es débil.
En vista de lo anterior, la gran mayoría de ácidos dipróticos poseen dos constantes de ionización o constantes de disociación ácida, Ka1 y Ka2.
Fórmula general de los ácidos dipróticos
Existen muchos ejemplos de ácidos diproticos con fórmulas químicas muy variadas. Sin embargo, en el contexto del cálculo de pH u otros cálculos relacionados con el equilibrio ácido-base se les suele representar por la fórmula genérica H2A, donde A representa el anión que se forma cuando el ácido pierde ambos protones. El anión A puede ser tan simple como un ion sulfuro y tan complejo como un ion orgánico con decenas de átomos.
Equilibrio ácido-base de los ácidos dipróticos
Como se mencionó anteriormente, la mayoría de los ácidos dipróticos son débiles y solo en contadas ocasiones poseen una disociación fuerte y otra débil. Esto resalta el hecho que poseer dos protones ionizables no quiere decir que los ácidos dipróticos los cedan simultáneamente. De hecho, la disociación es un proceso secuencial de pérdida de protones que involucra, en el caso de los ácidos dipróticos, dos equilibrios químicos y, por lo tanto, dos constantes de disociación ácida Ka1 y Ka2. Las reacciones químicas reversibles correspondientes se presentan a continuación:
1ra disociación de un ácido diprótico


2da disociación de un ácido diprótico


Cálculo de pH de las disoluciones de ácidos dipróticos
El cálculo del pH y de la concentración de todas las especies presentes en una disolución de un ácido diprótico, dada su concentración inicial o analítica, implica resolver simultáneamente los equilibrios iónicos mostrados anteriormente. Este tipo de problemas son considerablemente complejos, ya que estos dos equilibrios están conectados tanto por medio de la concentración de protones (H+) en la disolución, como por la concentración de la base conjugada del ácido original (HA–).
Como se puede ver en las ecuaciones de ambas constantes de equilibrio, hay en total 4 incógnitas que se deben hallar y que son [H2A], [HA–], [A2-] y [H+]. En vista de que solo se cuenta con dos ecuaciones (las dos constantes de equilibrio), se necesitan dos ecuaciones independientes adicionales para poder resolver este tipo de problemas. Los químicos analíticos llaman a estas ecuaciones balance de masa y balance de cargas eléctricas, que para este caso vienen dadas por:
Balance de masa
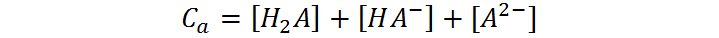
Esta ecuación expresa que la concentración total de un ácido diprótico, también llamada concentración analítica (Ca), está distribuida entre todas las especies ionizadas y no ionizadas del ácido, a saber, H2A, HA– y A2-.
Balance de carga
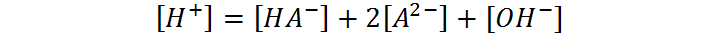
Esta ecuación, por su lado, expresa la condición de neutralidad de la disolución. Como la disolución debe ser neutra, la suma de todas las cargas positivas provenientes de todos los cationes presentes en la disolución (en este caso únicamente los protones) debe estar contrarrestada por las cargas negativas de todos los aniones.
La combinación de las ecuaciones de Ka1, Ka2, la constante de disociación del agua (Kw), el balance de masa y el balance de carga, proporciona una ecuación que permite hallar la concentración de protones y, a partir de allí, la de todas las demás especies en equilibrio. Esto es un proceso laborioso y complicado que escapa el objetivo del presente artículo; sin embargo, se puede resolver de manera aproximada despreciando la segunda disociación y tomando en cuenta solo la primera.
Ejemplos de ácidos dipróticos
A continuación se presentan algunos ejemplos de ácido dipróticos comunes. En los casos de los ácidos orgánicos se debe tomar en cuenta que solo los hidrógenos de los grupos carboxilo son ionizables, por lo que los que están unidos directamente a átomos de carbono no se toman en cuenta como protones.
Ácido sulfúrico (H2SO4)
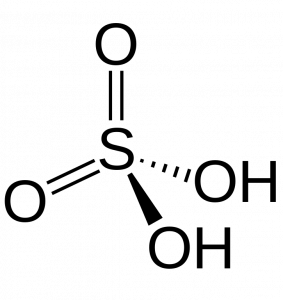
Ácido carbónico (H2CO3)

Ácido tereftálico (HOOC-C6H4 -COOH)

Otros ácidos dipróticos
- Ácido crómico (H2CrO4)
- Ácido oxálico (H2C2O4)
- Ácido butenodióico (HOOC-CH=CH-COOH)
- Ácido sulfhídrico (H2S)
- Ácido telurhídrico (H2Te)
- Ácido selenhídrico (H2Se)
Referencias
▷ Ácido diprótico: definición, fórmula y ejemplos. (2020, 29 octubre). Estudyando. https://estudyando.com/acido-diprotico-definicion-formula-y-ejemplos/
ÁCIDOS DIPRÓTICOS Y POLIPRÓTICOS – Conceptos básicos. (s. f.). Amanecer-temuco. https://www.amanecer-temuco.cl/wp-content/uploads/2020/05/4-Acidos-diproticos-y-poliproticos-Conceptos-basicos.pdf
Campillo, N. (2011). EQUILIBRIOS Y VOLUMETRÍAS ÁCIDO-BASE. Universidad de Murcia. https://www.um.es/documents/4874468/11830096/tema-5.pdf/e9fc6f0c-2d0d-4bca-8b07-6e1f03ff7c30
Chang, R. (2021). Quimica (11.a ed.). MCGRAW HILL EDDUCATION.
Ejemplos de Ácidos Dipróticos. (2015, 8 octubre). Químicas.net. https://www.quimicas.net/2015/05/ejemplos-de-acidos-diproticos.html
Libretexts. (2020, 30 octubre). 14.5: Ácidos polipróticos. LibreTexts Español. https://espanol.libretexts.org/Quimica/Libro%3A_Quimica_General_(OpenSTAX)/14%3A_Equilibrio_de_acido-base/14.5%3A_Acidos_poliproticos



