Tabla de Contenidos
Una curva de titulación ácido-base es una representación gráfica de los valores de pH de una disolución de un ácido o de una base en función del volumen de agente titulante añadido. Estas curvas normalmente presentan una forma sigmoidea (con forma de la letra s) y pueden presentar uno o más “escalones” que son indicativos del número de protones ionizables presentes en la muestra.
Usos de las curvas de titulación
Las curvas de titulación se pueden utilizar para determinar si una muestra contiene un ácido p una base fuerte o débil, si el ácido es monoprótico o poliprótico o si la base es monobásica o polibásica. Incluso puede utilizarse para determinar experimentalmente la concentración de una disolución de un ácido o de una base.
Determinación de la fuerza de un ácido o una base
La forma de la curva de titulación, así como sus distintos puntos de inflexión, pueden utilizarse para determinar si lo que se está titulando es un ácido fuerte o débil, o si se trata de una base fuerte o débil. Esto se debe a que, en el caso de ácidos y bases fuertes, el pH de la disolución durante la titulación viene determinado únicamente por la presencia de un exceso de ácido o de base fuerte en cada punto de la titulación antes y después del punto de equivalencia. Por esta razón, en estos casos la curva de titulación da un salto muy pronunciado (casi vertical) justo antes y después del punto de equivalencia.
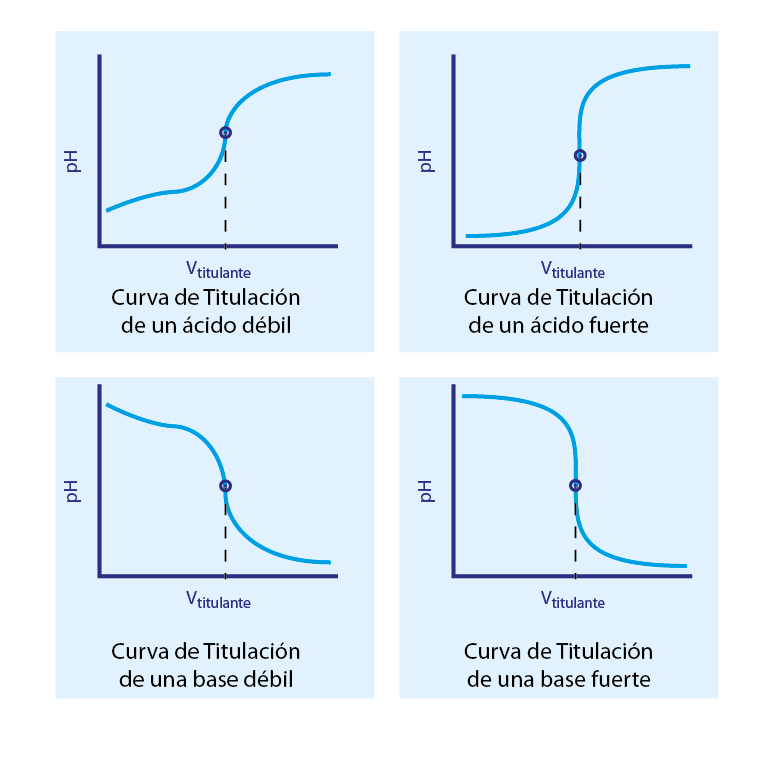
En cambio, en el caso de titulaciones de ácido o bases débiles, el pH antes del punto de equivalencia viene determinado por un sistema buffer que se forma al neutralizar parcialmente al ácido o la base débil. En estos casos, el sistema buffer amortigua los cambios de pH generados por la adición del agente titulante, haciendo que el cambio sea menos pronunciado que en el caso anterior. Además, el pH del punto medio entre el inicio de la titulación y el de equivalencia (que corresponde a un sistema buffer equimolar) es numéricamente igual al pKa del ácido o al pKb de la base, según sea el caso.
Determinación de la presencia de ácidos o bases monofuncionales o polifuncionales
Otra aplicación práctica y muy sencilla de las curvas de titulación es que permiten determinar de manera visual y muy rápida si la muestra que se está analizando contiene un solo ácido monoprótico, o si se trata de uno poliprótico. Incluso permite distinguir algunos casos en los que la muestra contiene mezclas no equimolares de más de un analito.
Esto se hace por medio de la observación del número de puntos de equivalencia (que se ven como saltos o escalones en la curva), y de la separación horizontal entre estos puntos. Una curva con varios saltos equidistantes puede tratarse de un ácido poliprótico (aunque también podría tratarse de una mezcla equimolar de dos ácidos con pKa diferentes).
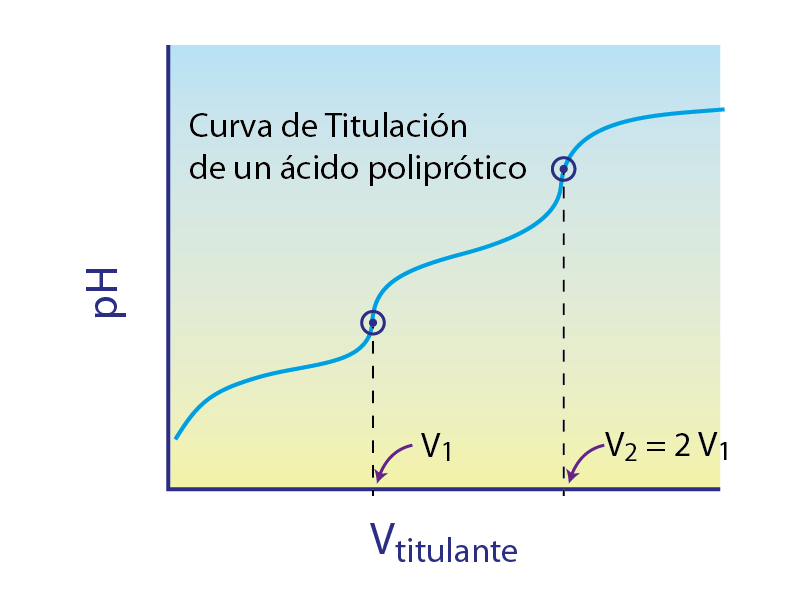
El mismo principio se aplica para casos de bases débiles monobásicas y polibásicas. Incluso se pueden establecer métodos analíticos que permiten confirmar la presencia de mezclas de ácidos y bases con sus respectivas sales conjugadas simplemente observando la forma de las curvas de titulación y los volúmenes de los puntos de equivalencia.
Determinación de la concentración de un analito
En una titulación normal, el punto de equivalencia de la titulación se estima a partir del punto final. Este se define como el punto en el que se observa un cambio en la disolución que generalmente se pone de manifiesto por un indicador que sufre un cambio observable de color (indicador ácido base).
Una vez conocido el volumen de agente titulante en el punto de equivalencia, este volumen junto con el volumen de la alícuota y la concentración conocida del titulante se pueden utilizar para determinar la concentración de la muestra desconocida por medio de la siguiente ecuación:
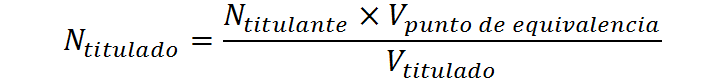
Determinación gráfica del punto de equivalencia
La determinación del punto de equivalencia a partir de una curva de titulación se puede llevar a cabo utilizando herramientas matemáticas computarizadas. Esto se puede lograr gracias al hecho de que el punto de equivalencia corresponde a un punto de inflexión en la curva de titulación. Este punto de inflexión se puede identificar fácilmente como el punto máximo de la derivada de la curva de titulación, la cual se puede determinar ajustando los puntos de la curva a un polinomio por medio de un programa informático.
Además, este punto de inflexión también implica un cabio de concavidad (de cóncavo a convexo en el caso de titulaciones de ácidos y viceversa en el caso de titulaciones de bases) por lo que la gráfica de la segunda derivada de la curva de titulación corta al eje X justamente en el volumen del punto de equivalencia.
Los valores del punto de equivalencia determinados de esta manera son mucho más exactos que los puntos finales obtenidos con una titulación convencional por medio del uso de indicadores ácido-base adecuados.
Cálculo de curvas de titulación
Las curvas de titulación se pueden obtener de manera teórica a partir del valor de la constante de ionización del ácido o de la base que se esté titulando, del volumen de la alícuota y en función de las concentraciones del titulante y del analito (es decir, el ácido o la base titulada).
A continuación, se presenta un ejemplo del cálculo de una curva de titulación para una muestra de ácido acético 0,1 M utilizando como titulante una disolución de hidróxido de sodio (NaOH) también 0,1 M con una alícuota de 50 mL. Dado que ambas concentraciones son iguales, el volumen del punto de equivalencia será igual al volumen de la alícuota, es decir, 50 mL. La constante de acidez de este ácido es de 1,78.10-5.
Para el cálculo de la curva de titulación, se determinarán los valores de pH en 7 puntos diferentes:
- pH inicial (VNaOH = 0)
- Punto medio antes del punto de equivalencia (VNaOH = 25 mL)
- Punto justo antes del punto de equivalencia (VNaOH = 45 mL)
- Punto de equivalencia (VNaOH = 50 mL)
- Punto justo después del punto de equivalencia (VNaOH = 55 mL)
- Punto medio luego del punto de equivalencia (VNaOH = 75 mL)
- Doble del punto de equivalencia (VNaOH = 100)
pH inicial (VNaOH = 0)
Antes de añadir NaOH a la disolución, lo que tenemos es una disolución 0,1 M de ácido acético, el cual es un ácido débil que se disocia según la siguiente ecuación:
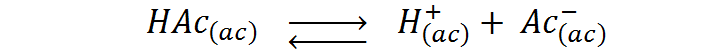
Si llamamos Ca a la concentración analítica del ácido y X a la concentración del ácido que se disocia, entonces las concentraciones en el equilibrio de todas las especies serán:
[HAc] = Ca – X ≈ Ca
[H+] = [AC–] = X
A partir de la ley de acción de masas obtenemos:
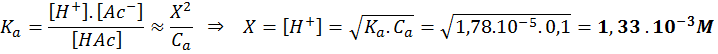
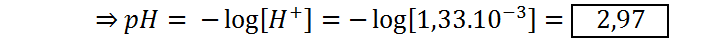
Punto medio antes del punto de equivalencia (VNaOH = 25 mL)
Al llegar al punto medio entre el inicio de la titulación y el punto de equivalencia, se ha neutralizado exactamente la mitad del ácido acético según la siguiente reacción química:
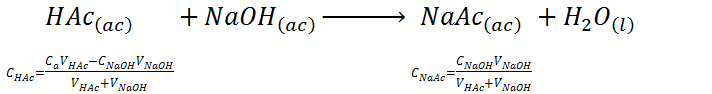
En este caso, se obtiene una mezcla de ácido acético con acetato de sodio, lo cual conforma un sistema buffer ácido débil/base conjugada cuyo pH se puede calcular utilizando la ecuación de Henderson-Hasselbalch:
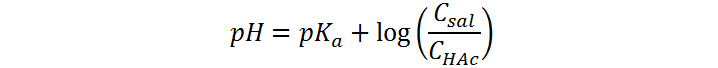
Como ambas concentraciones son iguales, el logaritmo vale cero y, por lo tanto, el pH es igual al pKa del ácido acético:
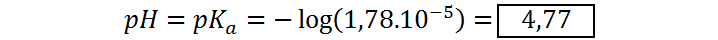
Punto justo antes del punto de equivalencia (VNaOH = 45 mL)
Como estamos antes del punto de equivalencia, seguimos teniendo un exceso de ácido que no ha sido neutralizado y la sal formada por la neutralización, así que aún tenemos el mismo sistema buffer que antes, solo que esta vez las concentraciones no son iguales y se deben calcular antes de utilizar la ecuación de Henderson-Hasselbalch:
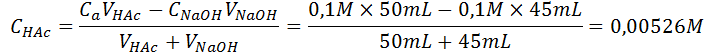
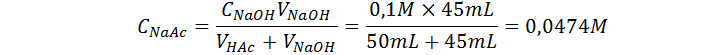
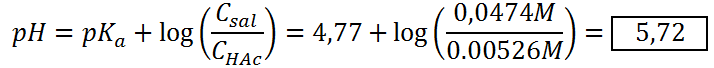
Punto de equivalencia (VNaOH = 50 mL)
En el punto de equivalencia, todo el ácido acético ha sido neutralizado y la disolución contiene únicamente acetato de sodio. La concentración de esta sal en este punto es:
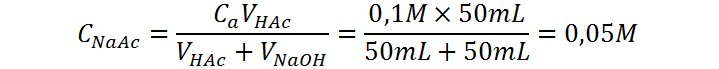
La hidrólisis de esta base conjugada está dada por la siguiente ecuación:

Por tratarse de la base conjugada de un ácido débil, se trata de una base débil cuyo Kb, viene dado por:

Llevando a cabo una aproximación similar a la que utilizamos al determinar el pH del ácido débil puro, podemos calcular [OH–] según la siguiente expresión:
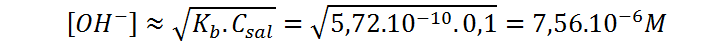

Punto justo después del punto de equivalencia (VNaOH = 55 mL)
Todos los puntos luego del punto de equivalencia consisten en mezclas de acetato de sodio con hidróxido de sodio. El pH en estos casos se calcula resolviendo el equilibrio de hidrólisis de la sal en presencia del efecto del ion común en forma del exceso de OH– provenientes del NaOH:
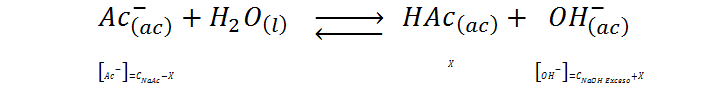
Las concentraciones iniciales de la sal y el exceso de NaOH son:
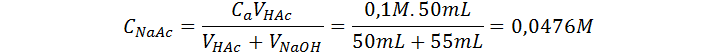
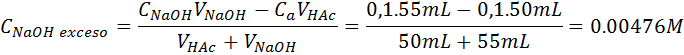
Debido al pequeño valor de la constante de basicidad y al efecto del ion común, la cantidad de acetato que se hidroliza es despreciable. Por esta razón, la concentración de hidróxido en la disolución será [OH–] = CNaOH exceso – X ≈ CNaOH exceso
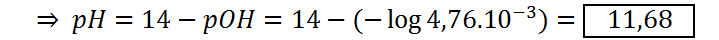
Punto medio luego del punto de equivalencia (VNaOH = 75 mL)
Este pH se calcula de la misma manera que el anterior:
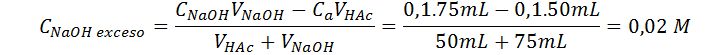
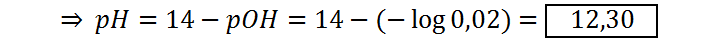
Doble del punto de equivalencia (VNaOH = 100)
Este pH se calcula de la misma manera que el anterior:
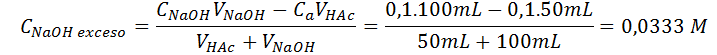
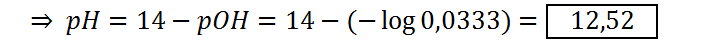
Con estos datos ya podemos construir la curva de titulación completa. Los puntos a graficar serán:
| VNaOH | pH |
| 0 | 2,97 |
| 25 | 4,77 |
| 45 | 5,72 |
| 50 | 8,88 |
| 55 | 11,68 |
| 75 | 12,30 |
| 100 | 12,52 |
Utilizando estos datos, la curva de calibración resultante es:
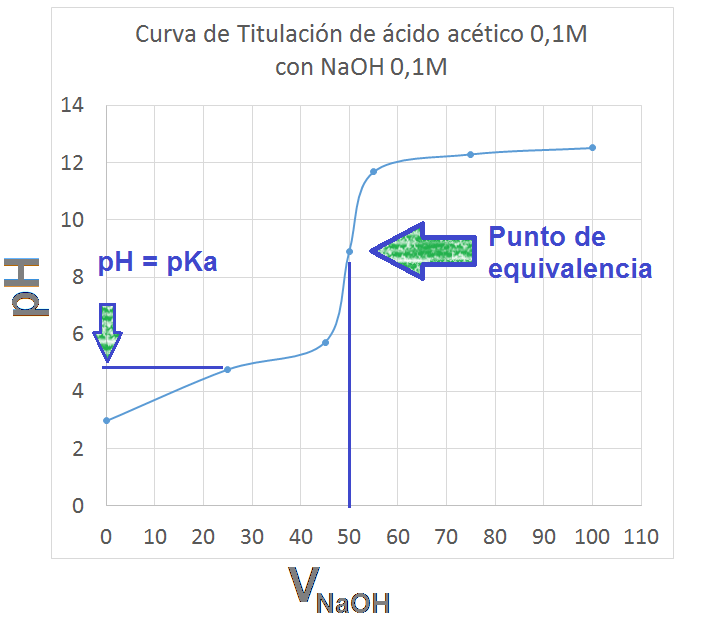
Como podemos observar, la curva tiene la típica forma de s con el punto de inflexión en su centro indicando el punto de equivalencia.
Referencias
Facultad de Ciencias Agrarias y Forestales. (s. f.). Curso de Análisis Químico – VOLUMETRÍAS ÁCIDO-BASE. UNLP. https://aulavirtual.agro.unlp.edu.ar/pluginfile.php/35335/mod_resource/content/2/8%20Volumetr%C3%ADa%20%C3%A1cido%20base.pdf
González Nuñez, V. (s. f.). CURVAS DE TITULACION DE ACIDOS & BASES. Universidad de Salamanca. https://diarium.usal.es/vgnunez/files/2012/11/2.-Curvas-de-titulaci%c3%b3n-de-%c3%a1cidos-bases.pdf
KhanAcademyEspañol. (2015, 9 agosto). Curvas de titulación e indicadores ácido-base [Vídeo]. YouTube. https://www.youtube.com/watch?v=iqEuJ8lKglw
Libretexts. (2020, 30 octubre). 14.7: Titulaciones de ácido-base. LibreTexts Español. https://espanol.libretexts.org/Quimica/Libro%3A_Quimica_General_(OpenSTAX)/14%3A_Equilibrio_de_acido-base/14.7%3A_Titulaciones_de_acido-base
Skoog, D. (2021). Quimica Analitica (7.a ed.). MCGRAW HILL EDDUCATION.



