Tabla de Contenidos
El concepto del mol está íntimamente ligado a todos los aspectos de la química. Es una medida de la cantidad de materia y está, por lo tanto, directamente relacionada con el número de átomos o moléculas presentes en una muestra de cualquier sustancia. En muchas formas el concepto de mol no es diferente al de la docena o el de la centena. Es decir, se trata simplemente de un número; un número muy grande, es cierto, pero un número puro al fin y al cabo.
Pero, ¿cómo determinamos el número de átomos en una muestra de sustancia si no podemos verlos? De la misma manera que podemos estimar el número de naranjas presentes en un costal sin necesidad de contarlas: Pesando algunas naranjas para determinar su peso promedio y luego pesando el costal completo.
Por ejemplo, si una naranja pesa 200 g, entonces habrá 5 naranjas en un kilogramo. Luego, si el costal pesa 20 kg, entonces contendrá 20*5=100 naranjas. Por otro lado, si el costal pesa 20 kg pero no contiene naranjas sino limones, entonces el número de limones en el saco no será el mismo que el número de naranjas, ya que los limones por lo general pesan menos.
Lo mismo se puede decir del proceso inverso. Si queremos saber cuánto pesan determinado número de naranjas o limones, solo necesitamos multiplicar este número por el peso de cada una de ellas.
El cálculo de moles a partir de los gramos y viceversa funciona de la misma manera. Se basa en la masa de cada mol de un tipo particular de átomo o molécula.
A continuación, veremos distintas maneras de llevar a cabo el cálculo de moles a partir de la masa de sustancia, así como el cálculo de la masa de una sustancia a partir del número de moles. Cualquiera de estas tres maneras de llevar a cabo los cálculos es perfectamente válida y dará el mismo resultado, aunque algunas son más prácticas que otras en determinados contextos, como se explica en adelante.
Cálculo de la masa molar
Al igual que para el ejemplo del saco de naranjas se requería conocer el peso de una naranja para poder determinar el número de naranjas en el costal, para calcular el número de moles a partir de los gramos, necesitamos conocer la masa de cada mol de partículas para poder determinar el número de moles presentes en una muestra. Esta se conoce como la masa molar, y es numéricamente igual a la masa molecular, la cual podemos calcular a partir de la fórmula molecular de la sustancia y de los pesos atómicos de los elementos que la conforman.
Esto se hace simplemente sumando los pesos atómicos de cada átomo que forma el compuesto o elemento. Por ejemplo, si deseamos calcular moles de nitrato de sodio a partir de su masa en gramos, necesitamos determinar la masa molar del nitrato de sodio, cuya fórmula es NaNO3. Esto se hace sumando las masas atómicas del sodio, del nitrógeno y de tres átomos de oxígeno:
| Elemento | Símbolo | Número de átomos | Peso atómico | Total |
| Nitrógeno | N | 1 | 14 | 14 |
| Oxígeno | O | 3 | 16 | 48 |
| Sodio | Na | 1 | 23 | 23 |
| PM | 85 |
Como podemos observar en la tabla, ninguna de las cantidades posee unidades. Esto se debe a que los pesos atómicos son cantidades relativas y adimensionales. Lo mismo sucede con el peso molecular, el cual se calcula a partir de dichos pesos atómicos relativos.
Sin embargo, la definición de las unidades relativas de peso atómico, así como la manera en que se definió el mol, aseguran que el peso molecular sea numéricamente igual a la masa molar. La única diferencia es que, cuando hablamos de masa molar, nos referimos a la masa de la sustancia que contiene exactamente 1 mol de sustancia, por lo que se le añaden las unidades de g/mol.
Ahora que sabemos cómo se calcula la masa molar de cualquier sustancia dada su fórmula molecular, veamos cómo esta se utiliza para determinar el número de moles a partir de la masa dada en gramos.
1. El método de la regla de tres
La forma más sencilla e intuitiva de calcular el número de moles a partir de la masa en gramos y viceversa es por medio de una simple regla de tres. Esta regla parte del concepto de la masa molar. Es decir, parte del hecho de que la masa molar corresponde a la masa en gramos que contiene 1 mol de unidades de una sustancia.
Este método es muy útil para acostumbrarse al concepto de moles y para facilitar la comprensión de los cálculos estequiométricos. Sin embargo, es mucho más largo de lo necesario y puede resultar inadecuado cuando se deben llevar a cabo muchos cálculos de moles en el mismo problema.
Ejemplo 1
Si tomamos el ejemplo del nitrato de sodio cuya masa molar, acabamos de ver, es de 85 g/mol, y quisiéramos determinar el número de moles presentes en 170g de dicha sustancia, podemos entonces plantearnos la siguiente pregunta:
¿Si sabemos que en 85g de nitrato de sodio hay 1 mol de dicho compuesto, entonces en 170g cuántos moles habrá?
Este es el caso clásico de una regla de tres en la que se relacionan, por medio de proporciones, tres variables conocidas con una incógnita que en este caso es el número de moles. Su solución se plantea de la siguiente manera:

Las reglas de tres se resuelven multiplicando los extremos de la diagonal conocida y dividiendo el producto entre el valor de la otra esquina. En este ejemplo:

Como podemos observar, las unidades de masa de NaNO3 se simplifican y el resultado queda expresado en moles de NaNO3.
Ejemplo 2
Ahora, supongamos que queremos calcular la masa de 0,125 moles de nitrato de sodio. Podemos partir de la misma regla de tres anterior, pero en este caso conocemos la esquina inferior derecha en lugar de la que está a la izquierda, ya que allí es donde está el número de mores.

En este caso, la solución implica multiplicar y dividir las esquinas opuestas al caso anterior:

2. Cálculo del número de moles a partir de los gramos por fórmula
La segunda forma de calcular el número de moles es utilizando la fórmula de moles. Esta es una fórmula muy sencilla que dice que el número de moles no es más que el cociente entre la masa de una sustancia y su masa molar. Es decir:

El método de la fórmula resulta práctico para algunas personas quienes acostumbran utilizar fórmulas de manera frecuente y para quienes aprenderse una fórmula más no representa ningún inconveniente. Por otro lado, la fórmula del número de moles es muy práctica cuando necesitamos una relación matemática determinada para resolver problemas de múltiples incógnitas que deben resolverse por medio de sistemas de ecuaciones.
De hecho, esta tal vez sea una de las fórmulas más utilizadas en la química, por lo que memorizarla y practicar su uso es esencial.
En el caso de que necesitemos calcular la masa, solo tenemos que despejar m de la fórmula.

Ejemplo 3
Calculemos el número de moles presentes en 150 g de ácido acético (CH3COOH), sabiendo que las masas atómicas del carbono, el hidrógeno y el oxígeno son 12, 1 y 16 respectivamente.
En este caso, como no conocemos la masa molar, debemos comenzar por allí.
| Elemento | Símbolo | Número de átomos | Peso atómico | Total |
| Carbono | C | 2 | 12 | 24 |
| Hidrógeno | H | 4 | 1 | 4 |
| Oxígeno | O | 2 | 16 | 32 |
| PM | 60 |
Así que el peso molecular del ácido acético es 60, lo que implica que su masa molar es de 60 g/mol. Por lo tanto, tenemos los siguientes datos:
- m = 150 g
- MM = 60 g/mol
Ahora, todo lo que debemos hacer es utilizar la fórmula para calcular los moles y, ¡Listo!

Ejemplo 4
Calculemos ahora los gramos de ácido acético presentes en 15 moles de esta sustancia. En este caso, utilizamos la segunda fórmula despejada.
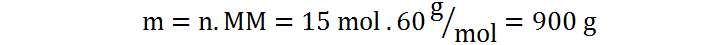
3. Cálculo del número de moles a partir de gramos como una transformación de unidades
Si lo que estamos buscando es la forma más práctica y rápida de llevar a cabo el cálculo de moles a partir de gramos, el método de los factores de conversión es sin duda el método a elegir. Este no solo sirve para calcular los moles a partir de los gramos sino también para el proceso contrario, es decir, el cálculo de los gramos a partir de los moles.
El proceso se basa en el uso de factores unitarios de conversión de unidades y en el concepto de la masa molar. Sabemos por dicho concepto que 1 mol de sustancia es equivalente a una masa molar de dicha sustancia.
Por ejemplo, en el caso del ácido acético cuyo peso molecular es 60, podemos escribir la siguiente equivalencia:

Esta equivalencia se puede reordenar haca ambos lados dando origen a dos factores de conversión distintos cuyos valores son 1. Es decir, para el ácido acético se verifica que:

El hecho de que el valor de ambas fracciones sea 1 significa que podemos multiplicar cualquier cantidad por estas fracciones y no cambiaríamos su valor. Esta es la razón por la que se denominan factores unitarios. Para calcular el número de moles utilizando factores de conversión, todo lo que debemos hacer es multiplicar por el factor que cancele las unidades de masa y que coloque en el numerador los moles, es decir, el factor de la izquierda.
En cambio, si deseamos calcular los gramos a partir de los moles, utilizamos el factor de la derecha.
Ejemplo 5
Calculemos el número de moles presentes en 0,120 g de cloruro de sodio (NaCl), sabiendo que tiene un peso molecular de 58,5.
En este caso, todo lo que debemos hacer es recordar que en este caso 1 mol de cloruro de sodio equivale a 58,5 g de la sal y viceversa y debemos utilizar esta información para crear el factor unitario de conversión adecuado y multiplicarlo por la masa en gramos.
Como estamos partiendo de gramos, y estos están en el numerador, debemos utilizar un factor unitario que tenga los gramos en el denominador para que se simplifiquen, mientras que el número de moles debe ir en el numerador para que el resultado quede en las unidades que estamos buscando:
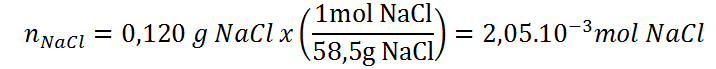
Ejemplo 6
Calculemos ahora cuántos gramos de sal necesitamos pesar para obtener 2,8.10-4 moles de la sal. En este caso, el procedimiento es exactamente igual, solo que debemos utilizar el otro factor unitario:

Referencias
Areaciencias. (2022, 13 enero). El Mol en Química y Numero de Moles con Ejercicios Resueltos. https://www.areaciencias.com/quimica/mol/
González, A. (2014, 12 febrero). FQ1 Cálculo moles a partir de la masa. Slideshare. https://www.slideshare.net/onio72/fq1-calculo-moles-a-partir-de-la-masa
Regla de tres. (2019, 2 septiembre). Mineduc.gob.gt. https://www.mineduc.gob.gt/DIGECADE/documents/Telesecundaria/Recursos%20Digitales/2o%20Recursos%20Digitales%20TS%20BY-SA%203.0/06%20MATEMATICA/U5%20pp%20122%20regla%20de%20tres.pdf
Timur : miembro planetcalc. (s. f.). Calculadora en línea: Convertir moles a gramos y gramos a moles. Planetcalc. https://es.planetcalc.com/6777/



