Tabla de Contenidos
¿Qué es un gas ideal?
Un gas ideal se define como aquel que cumple con la ley de los gases ideales bajo cualquier conjunto de condiciones. En otras palabras, es un gas cuya relación entre las cuatro variables de estado presión (P), volumen (V), temperatura absoluta (T) y número de moles, viene dada por:
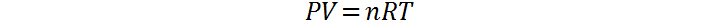
Esto sucede a cualquier presión y temperatura, sin importar el volumen en el que estén confinadas las partículas ni cuántas partículas estén presentes. Para que el comportamiento de un gas se ajuste a su vez a este comportamiento matemático, debe cumplir ciertas condiciones que se describen en lo que se denomina el modelo de los gases ideales. En dicho modelo, se entiende por gas ideal aquel que cumple las siguientes condiciones:
- Está formado por partículas puntuales, es decir, que tienen masa, pero no volumen.
- Forma un sistema en el que las partículas no interaccionan entre sí de ninguna manera, sin importar la distancia que las separe. Es decir, las partículas del gas ni se atraen ni se repelen entre sí.
- Las colisiones entre las partículas del gas y entre estas y las paredes del recipiente son perfectamente elásticas.
Un análisis rápido de este modelo da a entender por qué no se trata de un modelo real sino de una idealización en extremo simplificada del comportamiento de los gases. En primer lugar, al estar formados de materia, las partículas de un gas (esto es, átomos o moléculas) necesariamente poseen un volumen, lo que quiere decir que no son en realidad partículas puntuales. Además, los átomos que forman las partículas del gas están formadas por protones y electrones que poseen cargas eléctricas, razón por la cual siempre existirán atracciones y repulsiones electrostáticas entre una partícula y otra, en especial a corta distancia.
¿Qué es un gas real?
El modelo de los gases ideales funciona muy bien para describir situaciones en las que el tamaño de las partículas es despreciable, así como también lo son cualquiera de las interacciones entre sus partículas. Esto sucede cuando el gas es monoatómico (en cuyo caso las interacciones entre partículas son extremadamente débiles), la presión es muy baja (hay pocas partículas), la temperatura es alta (las partículas se mueven tan rápido y las interacciones son tan breves que no contribuyen significativamente a las propiedades del gas) y el volumen es muy grande en comparación con el tamaño de las partículas.
Sin embargo, cuando estas condiciones no se dan, la ley de los gases ideales resulta inadecuada, ya que no tiene en cuenta las características de un gas real. Existen otros modelos matemáticos que sí toman en cuenta aspectos tales como el tamaño que ocupan las partículas y las fuerzas de atracción que se pueden dar entre partículas. A cualquier modelo de un gas que trate de corregir las fallas del modelo de los gases ideales se le denomina, de forma genérica, gas real. Existen muchos modelos de gases reales, algunos relativamente simples, otros extremadamente complejos matemáticamente. El más simple de todos es el modelo de los gases reales de van der Waals.
Los gases de van der Waals
Un gas de van der Waals es un gas real que cumple la ecuación de estado de van der Waals. Esta ecuación parte de la ley de los gases ideales e incluye un conjunto de términos que buscan corregir la contribución de tamaño de las partículas del gas al volumen que ocupa el mismo, y de las interacciones entre las partículas a la presión efectiva que ejerce el gas sobre la superficie del recipiente que lo contiene.
La ecuación de estado de los gases de van der Waals viene dada por:
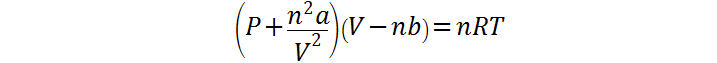
donde P, V, n, R y T son las mismas variables que en la ley de gases ideales, mientras que las constantes a y b son correctivos para modelar el comportamiento real los cuales dependen únicamente de la composición del gas.
La constante a mide la fuerza de atracción entre las partículas del gas. La atracción tiene el efecto de frenar las partículas antes de que estas choquen con la superficie, lo que reduce la presión efectiva del gas. Por esta razón, a la presión se le suma este término, el cual, además, es proporcional al cuadrado de la concentración de partículas (dado por la razón n/V).
Por otro lado, la constante b corresponde al volumen molar de las partículas que forman el gas, es decir, al volumen total que ocuparía un mol de partículas del gas si estuviera perfectamente empaquetado. Como muestra la ecuación, el volumen real que las partículas del gas tienen para moverse dentro del recipiente viene dado por el volumen de dicho recipiente (V), menos el volumen que ocupan las partículas (nb).
Problema de gas ideal versus no ideal (o real)
El siguiente problema ilustra el cálculo de la presión de dos muestras de gases diferentes en las mismas condiciones de temperatura, volumen y cantidad de moles utilizando la ecuación de los gases ideales, así como la ecuación de van der Waals. Después se calculan las presiones de nuevo en condiciones diferentes, y al final se comparan ambos resultados reales con los respectivos resultados ideales, y los resultados reales entre sí.
Enunciado
a) Determinar la presión de una muestra de helio gaseoso que contiene 0,300 mol del gas a 200°C en un recipiente de 5,00 L utilizando la ley de los gases ideales. Repita el cálculo utilizando la ecuación de van der Waals sabiendo que las constantes a y b para el helio son, respectivamente, 0,03457 L2.atm/mol2 y 0,0237 L/mol.
b)Repetir el cálculo para la misma cantidad del mismo gas, pero luego de reducir el volumen a 0,500 L y la temperatura hasta – 100°C.
b)Repetir los cálculos realizados en a) y b) para una muestra equivalente de monóxido de carbono gaseoso (CO) sabiendo que las constantes a y b para este gas son 0,151 L2.atm/mol2 y 0,03985 L/mol, respectivamente.
Solución del problema
Parte a)
Paso 1: Extraer los datos y la incógnita
El primer paso para resolver cualquier problema de este tipo es extraer los datos proporcionados en el enunciado y llevar a cabo cualquier conversión de unidades relevante. En el presente caso, tenemos el número de moles, la temperatura, el volumen y los dos parámetros de la ecuación de van der Waals para el helio, y se desea calcular tanto la presión ideal (la cual llamaremos Pideal) como la presión de van der Waals (PvdW). La temperatura se debe convertir a kelvin, ya que se necesita es la temperatura absoluta.
| n = 0,300 mol | T1 = 200 °C + 273,15 = 573,15 K | V1 = 5,00 L |
| a = 0,03457 L2.atm/mol2 | b = 0,0237 L/mol | |
| Pideal = ? | PvdW = ? |
Paso 2: Resolver la ecuación para hallar la presión
Ahora que tenemos los datos en las unidades adecuadas y además tenemos identificada la incógnita que es la presión, el siguiente paso es despejar esta incógnita de la ley de los gases ideales. Esto es tan sencillo como dividir ambos miembros de la ecuación entre el volumen:
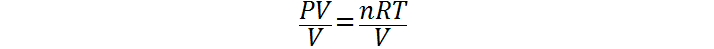
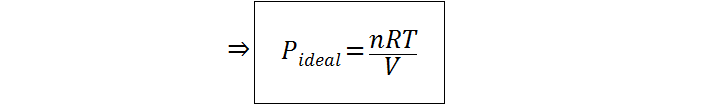
Paso 3: Reemplazar los datos y calcular la presión
El último paso consiste simplemente en reemplazar los valores de cada variable en la ecuación para luego calcular el valor de la incógnita. El valor que utilicemos de R determina las unidades finales de la presión. En este caso, utilizaremos R en unidades de atm.L/mol.K lo que implica que tendrá un valor de 0,08206:
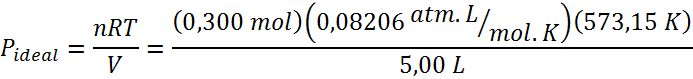
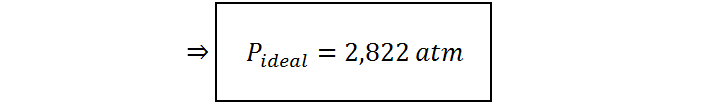
Los pasos 2 y 3 los repetimos para hallar la presión de van der Waals. En el caso, para resolver la ecuación se debe primero dividir ambos miembros entre (V-nb) y luego se debe restar en ambos miembros el término n2a/V2:
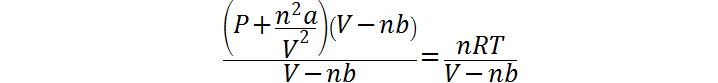
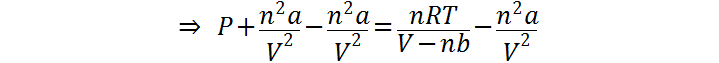
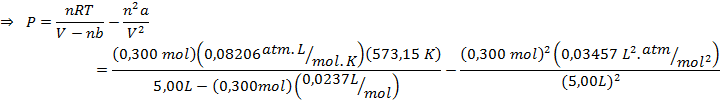

Parte b)
Esta parte se resuelve siguiendo los mismos pasos que se mostraron para las partes anteriores. En este caso, la temperatura y el volumen del gas cambian pero todo lo demás permanece igual. Los datos son:
| n = 0,300 mol | T2 = – 100°C + 273,15 = 173,15 K | V2 = 0,500 L |
| a = 0,03457 L2.atm/mol2 | b = 0,0237 L/mol | |
| Pideal = ? | PvdW = ? |
La presión ideal será, entonces:
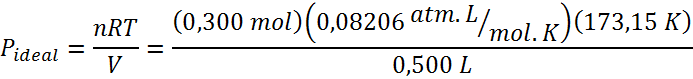
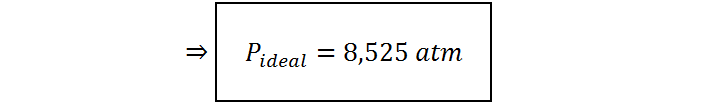
Por otro lado, la presión de van der Waals será:
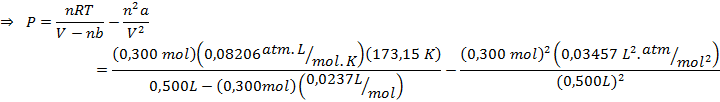
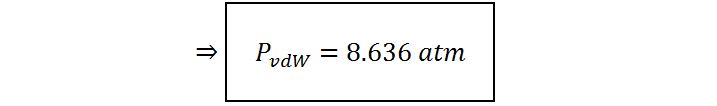
Parte c)
Al igual que la parte b, esta parte se resuelve siguiendo exactamente los mismos pasos que se mostraron para las partes a y b, pero con la salvedad de que se trata de monóxido de carbono en lugar de helio por lo que los valores de los parámetros de van der Waals son diferentes. Es decir que los datos para esta parte del problema son:
| n = 0,300 mol | T1 = 200 °C + 273,15 = 573,15 K | V1 = 5,00 L |
| T2 = – 100°C + 273,15 = 173,15 K | V2 = 0,500 L | a = 0,151 L2.atm/mol2 |
| b = 0,03985 L/mol | Pideal = ? | PvdW = ? |
En cuanto a las presiones ideales, como se trata del mismo número de moles, el mismo volumen y la misma temperatura, el resultado de ambas presiones ideales será el mismo, es decir, 2,822 atm y 8,525 atm.
En cambio, las presiones calculadas con la ecuación de van der Waals sí serán diferentes, ya que este modelo de gases reales sí considera las diferencias entre uno y otro gas. Sin embargo, la ecuación seguirá siendo la misma.
La presión de van der Waals para los 0,300 moles de monóxido de carbono a 200 °C en un volumen de 5,00 L resulta ser 2,828 atm. En cambio, la presión de la misma cantidad de este gas a – 100°C en un volumen de 0,500 L es 8,680 atm.
Análisis del resultado
La siguiente tabla resume los resultados del cálculo de las presiones ideales y no ideales para el helio y el monóxido de carbono a 200 °C y con un volumen de 5L.
| Helio (He) | Monóxido de carbono (CO) | |
| Pideal (atm) | 2,822 | 2,822 |
| PvdW (atm) | 2,826 | 2,828 |
La siguiente tabla resume los mismos resultados pero a – 100°C y con un volumen de 0,5L.
| Helio (He) | Monóxido de carbono (CO) | |
| Pideal (atm) | 8,525 | 8,525 |
| PvdW (atm) | 8,636 | 8,680 |
Estos resultados permiten observar claramente los efectos del comportamiento real de estos dos gases. Por un lado, al comparar las presiones ideales con las presiones de van der Waals a alta temperatura y con un volumen grande en comparación con al volumen ocupado por las partículas del gas, podemos notar que la diferencia es muy pequeña (2,822 versus 2,826 para el He y 2,822 versus 2,828 para el CO). Esto era de esperar, ya que estas condiciones (alta temperatura y baja presión) son justamente las condiciones en las que los gases reales se comportan de manera ideal. En consecuencia, es lógico que la ley de los gases ideales permita calcular con bastante exactitud la presión de ambos gases reales.
También podemos notar que la diferencia es mayor para el monóxido de carbono que para el helio. Esto también era de esperar, ya que el helio es el átomo más pequeño de la tabla periódica y es un gas monoatómico, que es lo más cerca que podemos estar, en el mundo real, a partículas puntuales que no interaccionan entre sí. En cambio, el monóxido de carbono no solo está formado por partículas mucho más grandes en comparación, sino que además son moléculas polares que exhiben interacciones dipolo-dipolo que son mucho más fuertes que las fuerzas de dispersión de London que se presentan en el helio.
Esto quiere decir que las características del monóxido de carbono lo alejan mucho más del comportamiento ideal que lo que sucede en el caso del helio. Por esta razón, las presiones reales del primero difieren de las ideales en mayor medida que las del segundo.
Finalmente, cuando analizamos los resultados a menor temperatura y un volumen 10 veces menor, podemos ver que la divergencia del comportamiento real del ideal se vuelve mucho más notable, en especial para el CO.
Referencias
Atkins, P., & de Paula, J. (2010). Atkins. Química física (8.a ed.). Editorial Médica Panamericana.
Chang, R. (2002). Fisicoquimica (1.a ed.). MCGRAW HILL EDDUCATION.
Franco G., A. (2016). La ecuación de van der Waals. sc.ehu.es. http://www.sc.ehu.es/sbweb/fisica3/calor/waals/waals.html
Ley de los gases ideales. (s. f.). Física de nivel básico, nada complejo.. https://www.fisic.ch/contenidos/termodin%C3%A1mica/ley-de-los-gases-ideales/
Olmo, M., & Nave, R. (s. f.). van der Waals Equation of State. HyperPhysics. http://hyperphysics.phy-astr.gsu.edu/hbasees/Kinetic/waal.html
Vega, P. D. R. (2015). Van der Waals, más que una ecuación cúbica de estado. Educación química. 26 (3). http://www.scielo.org.mx/scielo.php?script=sci_arttext&pid=S0187-893X2015000300187



