Tabla de Contenidos
El ácido sulfúrico (H2SO4) es uno de los ácidos minerales fuertes más conocidos. Es el oxácido del elemento azufre en su mayor estado de oxidación (VI) y proviene de la hidratación del anhídrido sulfúrico o trióxido de azufre (SO3). Se trata de un ácido diprótico cuya primera disociación es casi completa y cuya segunda disociación sigue siendo relativamente fuerte, por lo que el ion bisulfato (HSO4–) es un anión ácido.
Las disoluciones de ácido sulfúrico son ubicuas en los laboratorios de química y biología, donde se utiliza como reactivo químico, como catalizador y en algunos casos incluso como agente para limpiar materiales de laboratorio. En todas estas aplicaciones se requieren disoluciones de ácido sulfúrico de concentraciones diferentes, razón por la cual prepararlas es parte de los procesos rutinarios en estos laboratorios.
Dicho esto, es importante saber que preparar una disolución de ácido sulfúrico no se trata simplemente de mezclar el ácido con agua de cualquier manera, ya que hacerlo de la manera equivocada puede ser muy peligroso y llevar a accidentes verdaderamente serios.
¿Por qué mezclar ácido sulfúrico con agua es peligroso?
La razón por la que mezclar ácido sulfúrico con agua puede ser peligroso es porque las reacciones químicas que ocurren al combinar ambos compuestos son muy exotérmicas; es decir, liberan grandes cantidades de calor. Las reacciones en cuestión consisten en la disolución del ácido y la protonación del agua para formar iones hidronio:

También puede ocurrir una segunda disociación, pero esta es mucho menos importante que la primera:
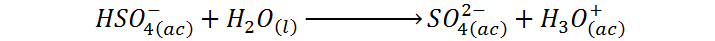
Ambas reacciones son exotérmicas y, si no se llevan a cabo de manera controlada, todo este calor puede aumentar rápidamente la temperatura de la disolución a más de 100°C, haciendo hervir o ebullir violentamente al agua (que tiene un menor punto de ebullición que el ácido sulfúrico puro). A su vez, esto produce salpicaduras de ácido concentrado que pueden caer en nuestros ojos, piel, ropa o en cualquier superficie del laboratorio.

Si esto sucede, podemos sufrir quemaduras muy graves, ya que el ácido sulfúrico concentrado destruye o carboniza casi instantáneamente cualquier materia orgánica con la que entra en contacto. De llegar a salpicarnos en los ojos, es muy probable que perdamos la vista.
Además, si por mala suerte inhalamos gotas de ácido sulfúrico concentrado y llegan a nuestro tracto respiratorio y pulmones, las quemaduras y demás lesiones pueden poner en peligro nuestra vida.
Afortunadamente, hay una manera de preparar disoluciones de ácido sulfúrico que minimiza el riesgo de producir chisporroteos y salpicaduras de ácido concentrado. Esto, junto con una serie de medidas de seguridad estándares en cualquier laboratorio de química, suelen ser suficientes para evitar la mayoría de los accidentes y minimizar su peligrosidad si llegaran a ocurrir.
La forma segura de preparar disoluciones a partir de ácido sulfúrico concentrado
La regla de oro al mezclar ácido sulfúrico con agua de manera segura es siempre agregar el ácido sulfúrico al agua y no el agua al ácido sulfúrico. Además, a medida que se añade el ácido sulfúrico concentrado, se debe agitar vigorosamente la disolución que se va formando.
Esto quiere decir que primero debemos agregar una cantidad considerable de agua en el balón aforado donde prepararemos la disolución (a lo que llamamos colchón de agua) y luego, poco a poco y bajo constante agitación, vamos agregando el volumen medido de ácido concentrado. Finalmente, se deja enfriar la disolución y se termina de aforar con agua pura.
También es importante sostener el balón aforado por el cuello en lugar de hacerlo por el bulbo o la parte más ancha que está en contacto directo con la disolución. Esto se debe a que esta última parte del balón se puede calentar considerablemente, llevando bien sea a quemaduras, o a que dejemos caer el balón accidentalmente, rompiéndose este y produciendo un peligroso derrame de ácido.
Justificación del procedimiento
¿Por qué se agrega el agua primero y el ácido después?
La razón por la que se prefiere agregar primero el agua y después el ácido es una consecuencia de las propiedades termodinámicas del sistema que se forma al mezclar ambos componentes. Si la disolución que vamos a preparar es considerablemente más diluida que la disolución comercial (que es aproximadamente 18 M), entonces la mezcla consistirá en una gran cantidad de agua y una pequeña cantidad de ácido concentrado.
Si agregamos primero el ácido y luego el agua, la pequeña cantidad de ácido tendrá una capacidad calórica (o calorífica) muy pequeña, por lo que una pequeña cantidad de calor causará un gran cambio de temperatura. En esta situación, será muy fácil calentar el ácido por encima de 100°C, causando la rápida ebullición del agua, como cuando agregamos unas gotas de agua a una sartén con aceite caliente.
En cambio, si agregamos un gran volumen inicial de agua antes de agregar el ácido concentrado, la capacidad calórica del sistema será mucho mayor, ya que el calor se deberá distribuir a lo largo de una mayor masa y la temperatura final será menor.
¿Por qué la agitación constante?
Se debe agitar constantemente porque la conductividad térmica de la disolución es limitada. En otras palabras, el calor liberado durante la disolución del ácido no se distribuye instantáneamente en toda el agua; este proceso requiere tiempo. Como consecuencia, si agregamos muy rápidamente el ácido sin agitar, es posible que el calor se acumule en un punto y que aumente la temperatura del agua localmente hasta ebullición, causando salpicaduras antes de que el calor se disipe en el resto del sistema.
Esto es lo mismo que sucede cuando la lava derretida o un metal incandescente se introduce de golpe en agua fría. Podemos ver claramente cómo el agua que entra en contacto directo con el hierro o con el magma estalla en ebullición mucho antes que el resto del agua se caliente.
La agitación acelera mecánicamente la distribución del calor en toda la disolución y evita que esto suceda.
Medidas de seguridad adicionales al preparar disoluciones de ácido sulfúrico
Además de seguir el protocolo mencionado para preparar la disolución, debemos observar las medidas de seguridad estándares del trabajo en el laboratorio, ya que las salpicaduras no son el único riesgo que se corre al manejar estas disoluciones. Estas medidas de seguridad incluyen:
- Utilizar bata de laboratorio para proteger la piel y la ropa. La mayoría de batas son fabricadas con materiales sintéticos capaces de soportar salpicaduras menores. Por otro lado, además de evitar daños a nuestra ropa, una gota de ácido en el pantalón o en una camiseta que pase desapercibida puede ocasionar quemaduras graves en la piel más adelante.
- Utilizar guantes de látex o nitrilo. Estos guantes son resistentes a muchos productos químicos, incluidas las disoluciones de ácido sulfúrico diluidas. En caso de entrar en contacto con el ácido concentrado, el guante proporciona suficiente protección para que dé tiempo de retirarlo antes de sufrir una quemadura.
- Utilizar lentes de seguridad. Es la mejor manera de proteger los ojos y buena parte de la cara.
- Recogerse el cabello en un moño o una cola de caballo. El cabello largo es un riesgo en el laboratorio. Puede entrar en contacto con el ácido o con otros reactivos, por lo que se debe mantener recogido en todo momento.
- Tener a la mano una piseta con una disolución de bicarbonato de sodio. El bicarbonato de sodio es una sal que produce disoluciones alcalinas capaces de neutralizar incluso el ácido sulfúrico concentrado. Rociar con bicarbonato la superficie que entre en contacto con el ácido en caso de un derrame es la primera medida que se debe tomar para detener su acción corrosiva.
Referencias
Chang, R. (2021). Química (11.a ed.). MCGRAW HILL EDDUCATION.
Dinamek. (2018, 30 noviembre). Cómo elegir el Guante resistente a químicos más adecuado. Dinamek website. https://www.dinamek.com/blog/como-elegir-el-guante-resistente-a-quimicos-mas-adecuado
How much heat will be released if a 98% (m/m) H2SO4 solution is diluted to 96% (m/m). (2019, 15 febrero). American Chemical Society Website. https://communities.acs.org/t5/Ask-An-ACS-Chemist/How-much-heat-will-be-released-if-a-98-m-m-H2SO4-solution-is/td-p/11867
Sippola, H., & Taskinen, P. (2014). Thermodynamic Properties of Aqueous Sulfuric Acid. Journal of Chemical & Engineering Data, 59(8), 2389–2407. https://pubs.acs.org/doi/pdf/10.1021/je4011147



