Tabla de Contenidos
Un agente tensioactivo, también llamado agente tensoactivo o surfactante, es una sustancia química capaz de reducir la tensión superficial de un líquido, lo cual mejora su capacidad para esparcirse sobre un área superficial mayor. Esto lo logran creando una capa de moléculas en la superficie del líquido o en la interfase entre dos líquidos.
Debido a su capacidad para reducir la tensión superficial, los agentes tensioactivos facilitan la dispersión de una fase líquida dentro de otra con la que es inmiscible. Como consecuencia, permiten la formación y estabilización de emulsiones entre dos líquidos, razón por la cual también se les denomina emulsionantes.
Estructura de los agentes tensioactivos
Los agentes tensioactivos se caracterizan por ser moléculas anfifílicas, lo que significa que una parte de la molécula es hidrofílica (tiene afinidad con el agua) mientras que la otra es hidrofóbica o lipofílica (tiene afinidad con las grasas).
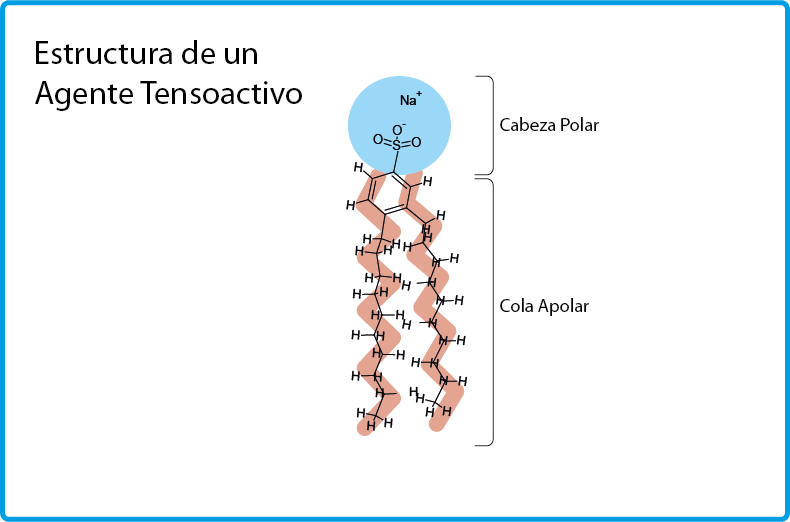
La cabeza polar
La parte hidrofílica de la molécula siempre contiene uno o más grupos funcionales polares concentrados en una porción relativamente pequeña de la molécula, a la cual se le suele denominar cabeza polar.
La cabeza polar siempre es capaz de formar uno o más enlaces de hidrógeno con el agua y con otros solventes próticos polares similares.
En algunos casos, la cabeza polar posee grupos funcionales polares neutros tales como grupos hidroxilos, ésteres de ácidos carboxílicos, éteres o una combinación de varios de ellos. En otros, posee grupos ionizables tales como carboxilatos e incluso ésteres de ácidos inorgánicos como el ácido sulfúrico (sulfatos) y del ácido fosfórico (fosfatos) que se encuentran ionizados. Algunas cabezas polares también poseen grupos con aminas cuaternarias (cationes amonio).
La cola hidrofóbica
La parte hidrofóbica o lipofílica de la molécula generalmente consiste en una cadena hidrocarbonada larga que puede o no contener insaturaciones, al igual que puede o no contener grupos aromáticos y otros grupos funcionales orgánicos apolares.
Debido al hecho de ser cadenas apolares largas de carbonos, a esta parte de la molécula se le suele llamar cola apolar.
Funcionamiento de los agentes tensioactivos
Como se mencionó anteriormente, los agentes tensioactivos actúan repartiéndose en la interfase entre un líquido (comúnmente agua) y otra fase, la cual puede ser un líquido apolar como un aceite o un gas como el aire. Esto disminuye la tensión superficial en la interfase, facilitando la mezcla de ambas fases y la formación de una emulsión. En el caso de que las fases sean agua y un aceite, la emulsión se puede formar de dos maneras distintas:
- La fase aceitosa se dispersa en forma de gotas dentro de una matriz acuosa, en cuyo caso se tiene una emulsión de aceite en agua (como sucede, por ejemplo, en la mayonesa)
- La fase acuosa se dispersa en una matriz de aceite, en cuyo caso se tiene una emulsión de agua en aceite (como en el caso de la mantequilla).
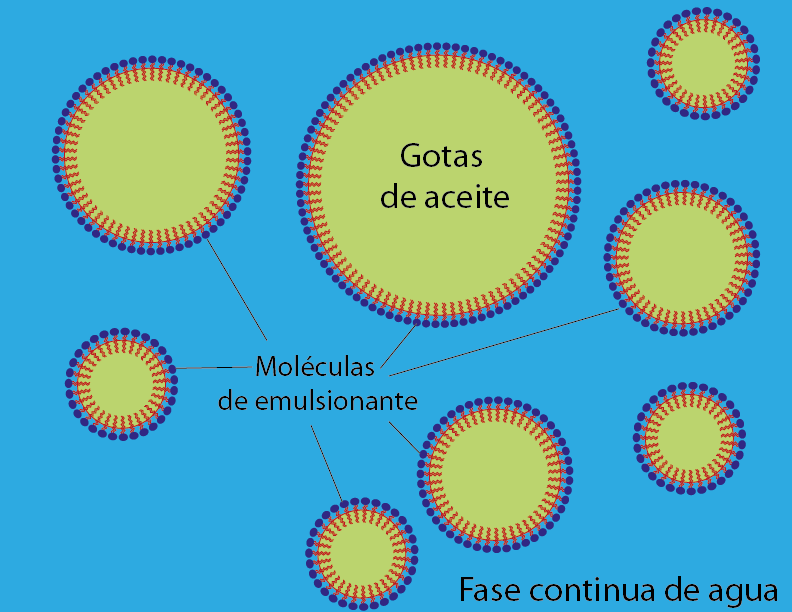
La forma en la que los agentes tensoactivos facilitan la formación de cualquiera de estos dos tipos de emulsión es básicamente la misma. Las moléculas del emulsificante se distribuyen en la interfase entre el agua y el aceite, repartiéndose de manera tal que la cabeza polar hidrofílica queda disuelta en la fase acuosa, mientras que la cola lipofílica queda disuelta en el aceite.
Si el agua se encuentra en mayor proporción que el aceite, entonces se formarán pequeñas gotas de aceite recubiertas de surfactante con las cabezas polares apuntando hacia afuera.
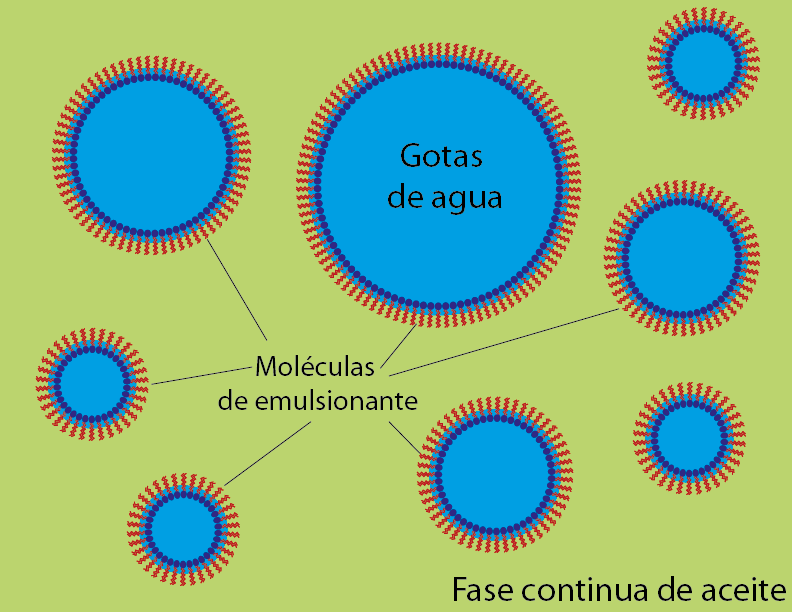
Si, de lo contrario, hay una mayor proporción de aceite, sucede lo contrario: se forman pequeñas gotas de agua recubiertas de moléculas de surfactante con las colas apolares apuntando hacia afuera.
Tipos de agentes tensioactivos
Los agentes tensioactivos se clasifican en cuatro grupos según las características de la cabeza polar: los tensioactivos no iónicos, los aniónicos, los catiónicos y los switeriónicos o anfóteros.
Tensioactivos no iónicos
Son aquellos cuya cabeza polar no contiene grupos polares ionizables, tales como los grupos hidroxilo en los alcoholes, los grupos éster y los éteres.
Tensioactivos aniónicos
Estos contienen grupos ácidos o sus sales alcalinas que se disocian al disolverse en agua, generando un ion con carga negativa o anión. Estos grupos cargados son fuertemente hidrofílicos (y por lo tanto fuertemente lipofóbicos), ya que pueden aceptar múltiples enlaces de hidrógeno del agua y también interactuar por medio de fuerzas ion-dipolo con el agua y con cualquier otro solvente polar.
Los jabones preparados por saponificación de las grasas son ejemplos de estos tensoactivos.
Tensioactivos catiónicos
Son lo contrario a los tensoactivos aniónicos. En este caso, la cabeza polar posee una carga positiva (o sea, es un catión). En la mayoría de los casos, estos surfactantes son derivados cuaternarios del amoníaco y se presentan en forma de sales con un halogenuro como contraión.
Un ejemplo de este tipo de surfactante catiónico es el DSDMAC o cloruro de diesterildimetilamonio.
Tensioactivos switteriónicos o anfóteros
Un switterión, también denominado sal interna, es una especie química que posee un número igual de cargas formales positivas y negativas en su estructura y, por lo tanto, no tiene carga neta. Los agentes tensioactivos switteriónicos proporcionan una polaridad mucho mayor que la de los agentes tensoactivos no iónicos; también proporcionan muchos de los beneficios de los surfactantes catiónicos y aniónicos, pero sin la adición de un contraión libre que queda disuelto en la fase acuosa.
Ejemplos típicos de agentes tensioactivos switteriónicos son los N-alquilaminoácidos y las sultaínas.
Ejemplos de tensioactivos
- El estearato de sodio es un tensioactivo aniónico.
- La taurina es un ejemplo de un tensioactivo switteriónico o anfótero.
- 4- (5-dodecil) bencenosulfonato también es un surfactante aniónico.
- Los polisorbatos como el Tween 20 y el Tween 80 son ejemplos de surfactantes o emulsificantes no iónicos utilizandos en la industria alimenticia y de cuidado personal.
- Docusato (dioctilsulfosuccinato de sodio).
- Fosfatos de éter de alquilo.
- Cloruro de benzalkaonium (BAC).
- Perfluorooctano (PFOS).
Referencias
Piorr R. (1987) Structure and Application of Surfactants. In: Falbe J. (eds) Surfactants in Consumer Products. Springer, Berlin, Heidelberg. https://doi.org/10.1007/978-3-642-71545-7_2
Chang, Q. (2016). Surface of Solution. Colloid and Interface Chemistry for Water Quality Control, 161–174. https://doi.org/10.1016/b978-0-12-809315-3.00009-8
Free, M. L. (2016). The Use of Surfactants to Enhance Particle Removal from Surfaces. Developments in Surface Contamination and Cleaning, 595–626. https://doi.org/10.1016/b978-0-323-29960-2.00013-7
Guill, I. (2019, 17 febrero). Tensioactivo y emulsionante ¿es lo mismo?, ¿son malos en cosmética? Recuperado 24 de julio de 2021, de https://mismimos.es/tensioactivo-y-emulsionante-es-lo-mismo/
Nakama, Y. (2017). Surfactants. Cosmetic Science and Technology, 231–244. https://doi.org/10.1016/b978-0-12-802005-0.00015-x



