Tabla de Contenidos
La constante de Faraday, representada por el símbolo F, es una de las constantes fundamentales en la física y la química y representa el valor absoluto o magnitud de la carga eléctrica de un mol de electrones. La constante lleva el nombre del físico y químico Michael Faraday, quien llevó a cabo importantes estudios sobre el electromagnetismo y electroquímica, especialmente sobre el proceso de electrólisis. Es una constante que se utiliza frecuentemente en cálculos físicos y químicos que involucran grandes cantidades de portadores de carga, tales como iones o electrones.
Ecuación de la constante de Faraday
Como representa el valor de la carga de un mol de electrones, la constante de Faraday se puede expresar en términos de la carga de cada electrón y del número de electrones que se encuentran en un mol de los mismos. La carga de cada electrón no es más que la carga elemental, e, una de las constantes universales más importantes en la física. Por otro lado, el número de electrones presentes en un mol de electrones viene dado por el número de Avogadro, NA, por lo que la constante de Faraday se puede expresar como:
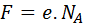
Valor de la constante de Faraday
Como toda constante que no sea adimensional, el valor de la constante de Faraday depende de las unidades en que se exprese. El valor de esta constante actualmente aceptado por el Instituto Nacional de Estándares y Tecnología de los Estados Unidos (NIST por sus siglas en inglés) en el sistema internacional de unidades (SI) es:
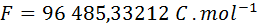
Sin embargo, es común utilizar esta constante en otras unidades para evitar la necesidad de llevar a cabo conversiones durante los cálculos:
| F = | 96 485,33212 A.s.mol-1 |
| F = | 26,80148114 A.h.mol-1 |
| F = | 96 485,33212 J.V-1.mol-1 |
| F = | 96,48533212 kJ.V-1.mol-1 |
| F = | 96 485,33212 J.V-1.equivalente-gramo-1 |
| F = | 96,48533212 kJ.V-1. equivalente-gramo -1 |
| F = | 23 060,54783 cal.V-1.mol-1 |
| F = | 23,06054783 kcal.V-1.mol-1 |
| F = | 23 060,54783 cal.V-1.equivalente-gramo-1 |
| F = | 23,06054783 kcal.V-1. equivalente-gramo -1 |
Usos de la constante de Faraday
En electrólisis
El primer uso que se le dio a la constante de Faraday es en el campo de la electrólisis. En el mismo, la constante de Faraday permite determinar la cantidad de carga eléctrica que se necesita transferir para producir determinada masa de una sustancia por electrólisis, o la masa o número de moles de sustancia producida, dada la cantidad de electricidad pasada por la celda. Esto se hace mediante la siguiente relación:
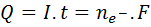
Donde I representa la intensidad de corriente en amperios (A), t es el tiempo de corrida en segundos (s), ne es el número de moles de electrones transferidos y F es la constante de Faraday. El número moles de electrones se puede determinar por estequiometría o simplemente por medio de la masa del metal dividida entre el peso equivalente del mismo:
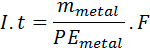
Esta ecuación o la anterior se puede resolver para hallar la variable deseada.
Ecuación de Nernts
Otro caso en el que se utiliza la constante de Faraday es en electroquímica, específicamente en el uso de la ecuación de Nernst. Esta ecuación permite calcular el potencial de reducción de un electrodo que se encuentra en condiciones no estándar (concentraciones distintas de 1M y/o presiones de gases distintas de 1 atm.).
Esta ecuación es:
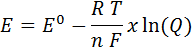
Donde Q es el cociente de reacción, E0 es el potencial estándar de reacción, n es el número de electrones transferidos en la reacción, T la temperatura absoluta, R la constante de los gases ideales, y F es la constante de Faraday.
El cociente de reacción para una reacción de tipo aA + bB → cC + dD, viene dado por el cociente del producto de las concentraciones de los productos elevados a sus coeficientes estequiométricos y el producto de las concentraciones de los reactivos elevados a los suyos:
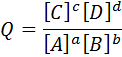
Cálculo del potencial de equilibrio de un ion en la membrana celular
La ecuación de Nernst también se puede utilizar para determinar el potencial de las celdas de concentración, las cuales contienen los mismos solutos, pero a concentraciones diferentes. Una aplicación particular de este uso es en el cálculo del potencial de equilibrio de un ion que se encuentra a concentraciones distintas en ambos lados de la membrana celular.
En este caso, el potencial estándar de reacción es cero (ya que no ocurre ninguna reacción química) por lo que el potencial de equilibrio viene dado por:
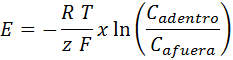
Donde z representa la carga eléctrica del ion (con todo y su signo), y Cadentro y Cafuera son las concentraciones del ion adentro y afuera de la célula, mientras todos los demás factores son iguales que antes.
Calculo de energía libre de Gibbs
Finalmente, otra aplicación de la constante de Faraday es en el cálculo de la variación la energía libre de Gibbs de una reacción de óxido-reducción que ocurre en una celda electroquímica. Esta relación viene dada por:
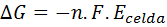
Donde Ecelda es el potencial de la celda electroquímica, n el número de electrones intercambiados y F es la constante de Faraday.
Cabe mencionar que estos son tan solo algunos ejemplos del uso de la constante de Faraday en química. Existen otras ecuaciones más en las que sale a relucir dicha constante.
Nota sobre el faraday y el faradio
Al llevar a cabo cálculos en electroquímica y en otras áreas, la constante de Faraday, F, aparece con frecuencia, como acabamos de ver. Pero también aparece una unidad de carga llamada faraday (con f minúscula). Se debe tener cuidado con no confundir el faraday con la constante de Faraday ya que no son lo mismo.
El faraday es una unidad adimensional de carga eléctrica que equivale a la carga liberada por un equivalente-gramo de sustancia involucrada en una reacción electroquímica.
Michale Faraday también llevó a cabo estudios sobre electromagnetismo, incluyendo estudios sobre capacitancia. En honor al prominente científico inglés, la unidad fundamental de capacitancia eléctrica se denominó faradio y nada tiene que ver con el faraday ni con la constante de Faraday.
Referencias
NIST, Fundamental Physical Constants
Bolívar, G. (2019, July 31). Constante de Faraday: aspectos experimentales, ejemplo, usos. Lifeder. https://www.lifeder.com/constante-de-faraday/
Chang, R. (2008). Fisicoquímica Para las Ciencias Químicas y Biológicas (3rd ed.). MCGRAW HILL EDDUCATION.
Chang, R., & Goldsby, K. (2013). Química (11th ed.). McGraw-Hill Interamericana de España S.L.
González, M. (2010, November 16). Constante de Faraday. La Guía de Química. https://quimica.laguia2000.com/conceptos-basicos/constante-de-faraday
Química.ES. (n.d.). Constante de Faraday. https://www.quimica.es/enciclopedia/Constante_de_Faraday.html



