Tabla de Contenidos
A pesar de que todos los cuerpos que entran en contacto entre sí se ejercen presión mutuamente, la presión es una magnitud física que solemos asociar con mucha más frecuencia con los gases que con los cuerpos sólidos.
En física, la presión se define como fuerza por unidad de superficie, y viene dada por el cociente F/A. Esto quiere decir que, para modificar la presión, solo debemos modificar o bien la fuerza, o bien el área sobre la que se aplica la fuerza. Por ejemplo, si quisiéramos aumentar la presión que ejercemos sobre, digamos, la superficie de una mesa, podríamos aumentar la fuerza (por ejemplo, agregando más peso o apretando más sobre la mesa), podríamos disminuir el área sobre la que aplicamos la fuerza (por ejemplo aplicando la fuerza con la punta de un clavo en lugar de con nuestra mano), o ambas cosas al mismo tiempo.
Sin embargo, ¿cómo podemos aumentar la presión que ejerce un gas? Más aún, ¿cómo es que los gases, siendo tan etéreos y carentes de forma, son capaces de ejercer presión sobre las paredes de los recipientes que los contienen? Comprender estos aspectos de una de las propiedades más importantes de los gases resulta extremadamente importante, ya que nos permite comprender muchos fenómenos que podemos observar diariamente, desde el inflado de las llantas de un automóvil, hasta la explosión de una lata sellada cuando esta se calienta demasiado, o incluso el comportamiento del clima.
Por esta razón, en el presente artículo exploraremos algunos aspectos básicos sobre la presión de los gases, así como las tres distintas formas en las que podemos aumentar la presión de un gas.
¿Cómo ejercen presión los gases?
Todo el que alguna vez haya asistido a una procesión o a algún evento deportivo, como por ejemplo un partido de futbol en el que hayan desplegado una bandera gigante sobre una multitud de personas, podrá comprender inmediatamente cómo ejercen presión los gases.

Los gases son sustancias formadas por partículas individuales que se mueven de forma independiente y aleatoria en todas direcciones. Cuando el gas está contenido dentro de un recipiente cerrado, estas partículas inevitablemente chocarán frecuentemente con las paredes del mismo. Cada colisión de una partícula del gas contra las paredes del recipiente es como una mano que empuja desde abajo a la bandera.
El asunto es que, debido al inmenso número de partículas que puede haber en cualquier muestra de un gas, estas colisiones ocurren con una frecuencia altísima, generando una fuerza casi constante que empuja a la superficie del recipiente. Eso es similar a los múltiples empujones que dan a la bandera desde abajo los espectadores, lo cual no deja que la bandera caiga, sino que la mantiene en un estado casi constante de tensión, como si estuviera inflada desde abajo.
Factores que afectan la presión de un gas y la ley de los gases ideales
Los gases son los sistemas más simples que estudia la química. De hecho, un gas que se comporte de forma ideal está completamente caracterizado por tan solo un puñado de variables que son el número de moles (n), el volumen (V), la temperatura (T) y, por supuesto, la presión (P). Estas cuatro variables (a las que se les dice funciones de estado) definen el estado de una muestra de cualquier gas, lo que significa que, si las conocemos, sabemos todos sobre el gas y podemos predecir su comportamiento en distintas situaciones.
A pesar de ser cuatro, en realidad solo necesitamos conocer 3 de ellas, ya que la cuarta la podemos hallar por medio de la ecuación de estado de los gases ideales, también conocida como la ley de los gases ideales, la cual viene dada por:
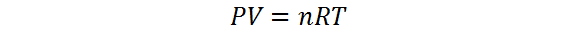
Lo anterior quiere decir que la presión de un gas viene determinada por los valores de las otras tres variables, i.e. el número de moles, la temperatura y el volumen y esta relación la podemos obtener despejando P de la ley de los gases ideales, como se muestra a continuación:
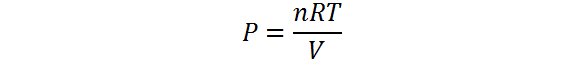
Cómo aumentar la presión de un gas
Como se puede ver en la ecuación anterior, la presión es directamente proporcional al número de moles y a la temperatura, pero inversamente proporcional al volumen. Esto significa que hay tres formas distintas para aumentar la presión, y estas son:
Aumentando el número de moles del gas
El hecho de que la presión sea directamente proporcional al número de moles significa que, a mayor número de moles, mayor será la presión. Esto implica que una manera de aumentar la presión es inyectando una mayor cantidad del gas dentro del recipiente que lo contiene. Un ejemplo de esto es cuando inflamos la llanta o el caucho de un automóvil, de una moto o de una bicicleta, o cuando inflamos un balón de baloncesto.
Lo que hace la bomba es introducir más partículas de gas dentro del recipiente. Pero, ¿por qué esto hace que aumente la presión? Para comprenderlo mejor, debemos recordar cómo es que los gases ejercen presión. La presión del gas es la consecuencia de las múltiples colisiones entre las partículas del gas y las paredes del recipiente. Si introducimos más partículas del gas, aumentará la frecuencia con la que estas partículas chocan con la superficie y, por lo tanto, aumentará la presión.
Aumentando la temperatura
La presión también es proporcional a la temperatura. Por lo tanto, al aumentar la temperatura, aumentará también la presión. Una situación cotidiana en la que podemos ver este fenómeno en acción es cuando calentamos demasiado una lata sellada y esta estalla debido al aumento de presión en su interior.
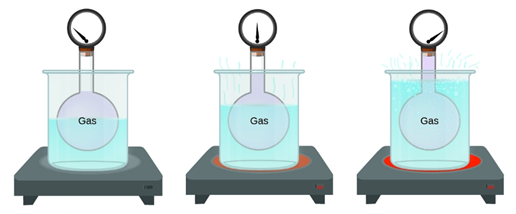
Para entender por qué la temperatura afecta la presión, debemos considerar lo que es la temperatura en sí. La temperatura es una medida de la energía cinética promedio de las partículas que forman a una sustancia. Por lo tanto, cambiar la temperatura implica cambiar la energía cinética de las partículas. Como estas no pueden cambiar su masa, entonces necesariamente cambiarán la rapidez con la que se mueven.
Al moverse las partículas del gas más rápidamente, suceden dos cosas:
- Por un lado, aumenta la frecuencia con la que las partículas chocan con las paredes, ya que cada partícula tarda menos en llegar desde una pared a la otra. Esto tiene el mismo efecto de antes de aumentar el número de partículas.
- Además de esto, al moverse más rápido, cada partícula transfiere una mayor cantidad de energía cinética a la pared durante la colisión, que es otra forma de decir que choca con más fuerza. Como más fuerza implica más presión, entonces esta última aumenta.
En resumen, el aumento de temperatura aumenta la presión porque causa un aumento del número de colisiones y también de la fuerza de cada colisión.
Reduciendo el volumen
A diferencia de la temperatura y del número de moles, la relación entre la presión y el volumen es inversa. Esto significa que, a menor volumen, mayor presión. Por lo tanto, la última forma de aumentar la presión es disminuyendo el volumen.
Aquí nuevamente el efecto tiene dos causas. La primera es que, al disminuir el volumen, disminuye el recorrido que cada partícula debe hacer para llegar de una pared a la otra del recipiente por lo que aumenta la frecuencia neta de colisiones. Además, la reducción de volumen generalmente viene acompañada de una reducción del área de superficie expuesta al gas. Recordando la definición original de presión, al disminuir el área, aumenta la presión.
Referencias
Atkins, P., & de Paula, J. (2014). Atkins’ Physical Chemistry (Ed. rev.). Oxford, United Kingdom: Oxford University Press.
Brown, T. (2021). Química: La Ciencia Central (11ra ed.). Londres, Inglaterra: Pearson Education.
Chang, R., Manzo, Á. R., López, P. S., & Herranz, Z. R. (2020). Química (10ma ed.). New York City, NY: MCGRAW-HILL.
CK-12 Foundation. (2020, 18 mayo). Factors Affecting Gas Pressure. Recuperado de https://www.ck12.org/chemistry/factors-affecting-gas-pressure/lesson/Factors-Affecting-Gas-Pressure-CHEM/
Flowers, P. (2018, 19 octubre). Relating Pressure, Volume, Amount, and Temperature: The Ideal Gas Law – Chemistry: Atoms First 2e. Recuperado de https://opentextbc.ca/chemistryatomfirst2eopenstax/chapter/relating-pressure-volume-amount-and-temperature-the-ideal-gas-law/
Socratic. (2014, 26 mayo). What causes gas pressure? Recuperado de https://socratic.org/questions/what-causes-gas-pressure



