Tabla de Contenidos
Se presenta a continuación una lista completa de todos los elementos no metales. A pesar de ser un grupo minoritario en la tabla periódica, estos elementos tienen propiedades químicas muy diversas y son capaces de formar miles de compuestos diferentes, con propiedades tan especiales que incluso han permitido el desarrollo de la vida en la tierra.
En total son 20 elementos no metálicos, distribuidos a lo largo de 6 grupos o familias en la tabla periódica.
¿Cuáles son los elementos no metales?
Los elementos no metales son los conformados por el hidrógeno y los elementos que ocupan el extremo superior derecho de la tabla periódica. Son aquellos elementos que poseen propiedades químicas y físicas opuestas a los metales. Algunas de las propiedades más sobresalientes de los no metales son:
- Son malos conductores del calor y de la electricidad.
- Pueden encontrarse tanto en estado sólido como en estado líquido y gaseoso.
- Tienen una alta electronegatividad.
- Forman enlaces covalentes entre ellos mismos.
- Forman óxidos ácidos.
- Pueden formar compuestos con estados de oxidación tanto positivos como negativos.
- No tienen brillo.
- Son poco dúctiles y maleables.
- Tienen puntos de fusión bajos.
Importante acotación sobre los elementos metales y no metales
Es importante comprender que el carácter metálico no es una propiedad que “o se tiene” o “no se tiene”, es decir, no es una situación de blanco y negro. Lo mismo se puede decir del carácter no metálico. Por ejemplo, una propiedad de los metales, ausente en los no metales, es que son buenos conductores de la electricidad. Sin embargo, el carbono es un buen conductor eléctrico y aun así se le considera un no metal.
Un ejemplo inverso es el caso de las propiedades ácido/base de los óxidos. Los metales en general producen óxidos básicos, mientras que los no metales producen óxidos ácidos que se transforman en oxácidos al reaccionar con agua. A pesar de ser un metal de transición, el cromo es capaz de formar varios óxidos ácidos y los respectivos ácidos oxácidos.
NOTA: Existen en la tabla periódica elementos que no se pueden clasificar ni como metales, ni tampoco como no metales, por lo que se les clasifica como metaloides. Desde cierto punto de vista, al no poseer todas las características de los metales, se podría decir que los metaloides no son metales. Sin embargo, haremos la distinción entre «no ser un metal», y «ser un no metal», por lo que no se incluirán a los metaloides en la lista de todos los no metales.
Lista de todos los no metales ordenados por número atómico
| Elemento | Símbolo químico | Número Atómico | Grupo | Configuración electrónica de la capa de valencia |
| Hidrógeno | H | 1 | 1 | 1s1 |
| Helio | He | 2 | 18 | 1s2 |
| Carbono | C | 6 | 14 | 2s22p2 |
| Nitrógeno | N | 7 | 15 | 2s22p3 |
| Oxígeno | O | 8 | 16 | 2s22p4 |
| Flúor | F | 9 | 17 | 2s22p5 |
| Neón | Ne | 10 | 18 | 2s22p6 |
| Fósforo | P | 15 | 15 | 3s23p3 |
| Azufre | S | 16 | 16 | 3s23p4 |
| Cloro | Cl | 17 | 17 | 3s23p5 |
| Argón | Ar | 18 | 18 | 3s23p6 |
| Selenio | Se | 34 | 16 | 4s24p4 |
| Bromo | Br | 35 | 17 | 4s24p5 |
| Kriptón | Kr | 36 | 18 | 4s24p6 |
| Yodo | I | 53 | 17 | 5s25p5 |
| Xenón | Xe | 54 | 18 | 5s25p6 |
| Astato | At | 85 | 17 | 6s26p5 |
| Radón | Rn | 86 | 18 | 6s26p6 |
| Téneso | Ts | 117 | 17 | 7s27p5 |
| Oganesón | Og | 118 | 18 | 7s27p6 |
Esta lista es particularmente útil ya que muestral claramente una de las características principales de la configuración electrónica de los no metales: que, excepto en los casos del hidrógeno (H) y del helio (He), los electrones de valencia se encuentran siempre en un subnivel p.
Por ejemplo, se puede observar claramente que el flúor posee una configuración electrónica con 7 electrones de valencia, 5 de los cuales se encuentran en orbitales 2p (2s22p5).
Lista de todos los elementos no metales en orden alfabético
En ocasiones resulta conveniente tener a la mano la lista de todos los no metales ordenados alfabéticamente. La misma se presenta a continuación junto con el símbolo químico y el número atómico.
| Elemento | Símbolo químico | Número atómico |
| Argón | Ar | 18 |
| Astato | At | 85 |
| Azufre | S | 16 |
| Bromo | Br | 35 |
| Carbono | C | 6 |
| Cloro | Cl | 17 |
| Criptón | Kr | 36 |
| Flñuor | F | 9 |
| Fósforo | P | 15 |
| Helio | He | 2 |
| Hidrógeno | H | 1 |
| Iodine | I | 53 |
| Neón | Ne | 10 |
| Nitrógeno | N | 7 |
| Oganessón | Og | 118 |
| Oxígeno | O | 8 |
| Radón | Rn | 86 |
| Selenio | Se | 34 |
| Teneso | Ts | 117 |
| Xenón | Xe | 54 |
Lista de los elementos no metálicos separados por grupos o familias
Una característica importante de los no metales es que poseen propiedades químicas muy variadas, tal como se mencionó al principio de este artículo. Sin embargo, existen elementos no metales que poseen propiedades similares entre sí, conformando grupos o familias. Estas familias coinciden con los grupos de la tabla periódico.
El Hidrógeno (Grupo 1, antiguamente IA)
El hidrógeno es el elemento más ligero de la tabla periódica. Es considerado como un no metal, aunque presenta propiedades de metal alcalino a altas presiones. Solo posee un electrón de valencia y puede formar enlaces tanto covalentes como iónicos.
El Carbono (Grupo 14, antiguamente IVA)
El carbono es el único del grupo 14 que se considera un verdadero no metal. El silicio posee propiedades similares al carbono, pero tiene otras más cercanas a las de los metales por lo que se le considera un metaloide. El carbono es el elemento base de la vida, pudiendo formar cientos de miles de compuestos distintos con distintas propiedades gracias al hecho de ser tetravalente.
Lista de no metales Nitrogenoides (Grupo 15, antiguamente VA)
El grupo 15 de la tabla periódica contiene dos elementos considerados no metales. Ambos tienen 5 electrones de valencia, tres de los cuales están desapareados y con los cuales forman enlaces covalentes con otros átomos.
- Nitrógeno (N): es un elemento que se encuentra en forma natural como un gas diatómico. Es el principal componente del aire, representando cerca del 80% del mismo. Es otro de los elementos importantes para la vida, formando parte de todas las proteínas, del ADN, del ARN, de las vitaminas y de múltiples otros compuestos orgánicos.
- Fósforo (P): Componente esencial de las células ya que constituyen una parte importante de la membrana fosfolipídica que rodea al citoplasma. Se encuentra en dos formas alotrópicas llamadas fósforo blanco y fósforo rojo. El fósforo blanco se caracteriza por arder espontáneamente en presencia de oxígeno, lo que lo hace un agente incendiario muy utilizado.
Lista de no metales calcógenos o anfígenos (Grupo 16, antiguamente VIA)
Los calcógenos o anfígenos (los elementos del grupo 16) corresponden a los elementos de la familia del oxígeno. Como se puede observar en la primera tabla, estos tres elementos poseen 6 electrones de valencia. Su valencia más común es -2, aunque pueden presentar otras. En este grupo hay tres elementos que son no metales:
- Oxígeno (O): Es un elemento que se encuentra de forma natural a temperatura ambiente como un gas diatómico. Es un elemento muy electronegativo que puede formar diversos aniones tanto mono como diatómicos. Se combina tanto con metales como con otros no metales y también es parte esencial de las biomoléculas que permiten la vida.
- Azufre (S): Este elemento se consigue en forma natural, especialmente en zonas volcánicas en forma de un sólido de color amarillo. Tiene algunas propiedades similares al oxígeno, y además de ser de gran importancia para la vida, también es muy importante en la industria.
- Selenio (Se): El selenio aún se considera un no metal, a pesar de su apariencia metálica. Fuera de esta apariencia, las propiedades químicas lo hacen más cercano a los no metales que a los metaloides, formando parte de compuestos orgánicos, constituyendo un micronutriente esencial para la vida, y encontrando muchas aplicaciones entre las que está su uso como aditivo para la fabricación de vidrios y como agente activo en champús para el tratamiento de la seborrea.
Lista de los Halógenos (Grupo 17, antiguamente VIIA)
La característica principal de los halógenos es que poseen siete electrones de valencia, por lo cual tan solo les falta uno para completar su capa de valencia y adquirir la configuración electrónica de un gas noble. Esto los hace particularmente electronegativos y hace que tengan afinidades electrónicas muy altas. Todos los elementos del grupo de los halógenos son no metales:
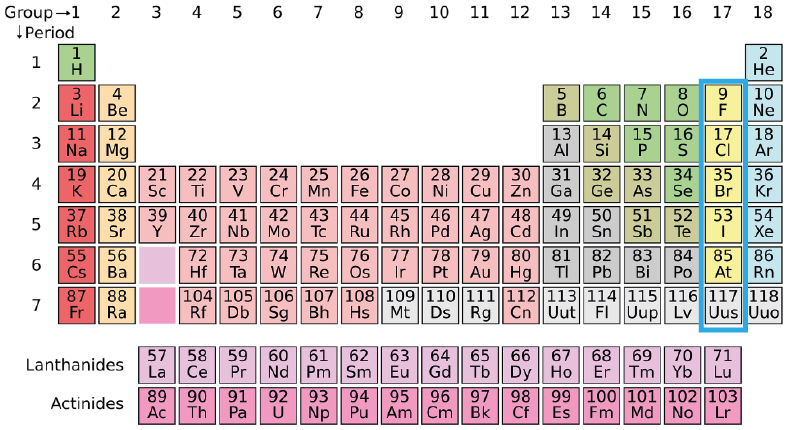
- Flúor (F): Es el elemento más electronegativo de la tabla periódica. También es uno de los más pequeños en términos de su radio atómico. En condiciones normales de temperatura y presión es un gas diatómico muy tóxico y reactivo.
- Cloro (Cl): También es un gas diatómico en condiciones normales, altamente tóxico y reactivo, aunque menos reactivo que el flúor. El cloro tiene un sinfín de aplicaciones que van desde la ciencia, la industria hasta la cocina. Forma parte de la sal común de mesa, de múltiples catalizadores para reacciones orgánicas y como agente desinfectante para el tratamiento del agua.
- Bromo (Br): A diferencia de los dos anteriores, éste es un líquido en condiciones normales. De hecho, es el único no metal que se presenta en estado líquido en dichas condiciones. Es denso e irritante y sus derivados se utilizan, entre otras cosas, para preparar tinturas, como aditivo para la gasolina, como sedantes, etc.
- Yodo (I): Es un elemento sólido de color morado intenso. Es un compuesto muy volátil que sublima fácilmente en condiciones ambientales. Se utiliza como agente desinfectante y como parte de muchos medicamentos.
- Astato (At): Es un elemento radiactivo muy pesado. Su número atómico es 85 y su isótopo más estable tiene un número de masa de 210.
- Téneso (Ts): Es el elemento 117 de la tabla periódica. Es un elemento sintético antiguamente llamado Efelio, y es el segundo elemento más pesado conocido por el hombre. No se sabe nada de su química por su corta vida media.
Lista de los gases nobles (Grupo 18, antiguamente VIIIA)
Los gases nobles corresponden al último grupo de la tabla periódica, el grupo 18. Se caracterizan por ser gases monoatómicos muy estables que rara vez forman algún tipo de compuesto químico. Su estabilidad proviene del hecho de que poseen su capa de valencia completamente llena, lo cual es energéticamente favorable desde el punto de vista de la mecánica cuántica.
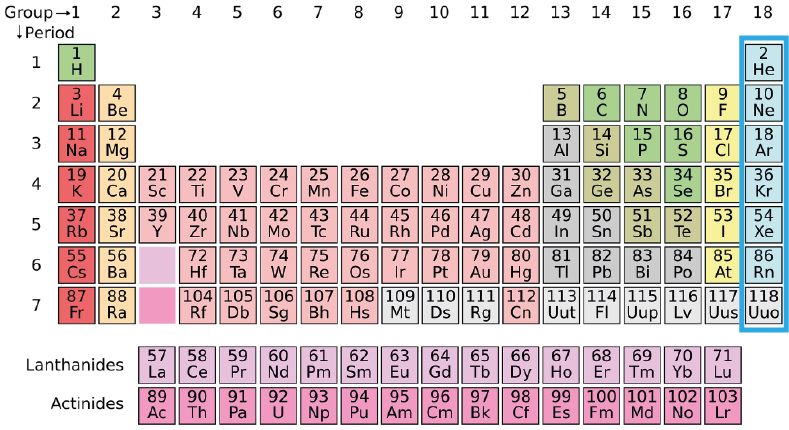
Existen siete gases nobles en la tabla periódica:
- Helio (He)
- Neón (Ne)
- Argón (Ar)
- Kriptón (Kr)
- Xenón (Xe)
- Radón (Rn)
- Oganesón (Og)
Los primeros seis se encuentran en la naturaleza como gases monoatómicos incoloros, inodoros, insípidos y, salvo algunas excepciones, completamente no reactivos. El radón es radiactivo y el oganesón es el elemento sintético más pesado producido jamás. Al igual que con el téneso, se sabe muy poco del oganesón ya que una vez sintetizado rápidamente se descompone.
Fuentes
- Chang, R. and Goldsby, K. (2014). Chemistry. 11th ed. New York: McGraw-Hill Education.
- Cotton, F. A., & Wilkinson, G. (1988). Advanced inorganic chemistry. New York: Wiley.



