Tabla de Contenidos
La ley combinada de los gases ideales es una ecuación matemática que relaciona la presión, la temperatura, el volumen y el número de moles de un gas ideal cuando éste sufre un cambio de estado. La razón por la que se denomina ley “combinada” es que esta relación proviene de la combinación de todas las demás leyes de los gases, incluyendo la Ley de Boyle, la Ley de Charles, la Ley de Gay-Lussac y la Ley de Avogadro.
La fórmula de la ley combinada de gases es:
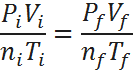
Donde P, V, n y T representan respectivamente la presión, el volumen, el número de moles y la temperatura absoluta, y los subíndices i y f se refieren al estado inicial y final. En otras palabras:
| Pi | = | Presión inicial | Pf | = | Presión final |
| Vi | = | Volumen inicial | Vf | = | Volumen final |
| ni | = | Número de moles inicial | nf | = | Número de moles final |
| Ti | = | Temperatura absoluta inicial | Tf | = | Temperatura absoluta final |
Esta ley establece que, cuando un gas sufre un cambio de estado, cualquiera que sea, la razón entre el producto de la presión y el volumen y el producto de la temperatura y el número de moles permanece constante.
¿La ley combinada de los gases incluye o no a la ley de Avogadro?
Desde cierto punto de vista, la ley combinada de los gases resulta ser la misma ley de los gases ideales, pero escrita de una forma levemente distinta. Por esta razón, y para hacer la distinción entre las dos, algunas personas consideran como la ley combinada, la que combina solo las leyes de Boyle, Charles y Gay-Lussac, sin incluir la de Avogadro. En este caso, se hace necesario restringir la ley a aquellos casos en los que el número de moles permanece constante, ya que ésa es una condición común a las tres leyes mencionadas. Esta versión de la ley combinada queda:
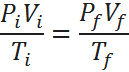
Donde las variables son las mismas que se mencionaron anteriormente.
Obtención de la ley combinada de los gases ideales
Sea cual sea el caso, la forma como se obtiene la ley combinada es básicamente la misma. Se parte de las leyes individuales que son:
La ley de Boyle
Establece que, si se mantienen constantes la temperatura y el número de moles, el volumen es inversamente proporcional a la presión. Esto se expresa matemáticamente como:
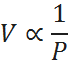
La ley de Charles y Gay-Lussac
Esta ley establece que, si se mantienen la presión y el número de moles constantes, entonces el volumen será directamente proporcional a la temperatura. En otras palabras:
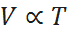
La ley de Avogadro
Finalmente, la ley de Avogadro establece la relación entre el volumen de un gas y el número de moles si se mantienen la presión y la temperatura constantes. Bajo estas condiciones, el volumen es directamente proporcional al número de moles:
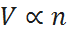
La ley combinada de los gases
La combinar estas tres leyes de proporcionalidad se puede ver claramente que el volumen es simultáneamente proporcional a la temperatura, al número de moles e inversamente proporcional a la presión, así que:

Agregando una constante de proporcionalidad, esto se transforma en:
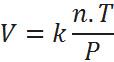
Finalmente, reordenando:
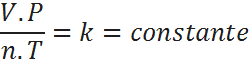
Si la fracción del miembro izquierdo de la ecuación es constante bajo cualquier set de condiciones, entonces será igual al inicio y al final de un cambio de estado, así que:
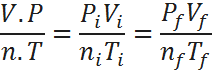
Que es la ecuación que presentamos al principio.
Ejemplos de la aplicación de la ley combinada de los gases
La ley combinada de los gases es muy útil, ya que puede reemplazar todas las demás leyes de gases. Esto quiere decir que sirve para resolver problemas de cambios de estado en los cuales permanecen constantes cualquier par de variables (n y V; n y T; n y P, etc.), e incluso aquellos en los que no permanezca constante ninguna de ellas.
Ejemplo 1
Determine el volumen a nivel del mar de una burbuja de aire que se encuentra inicialmente a 100 m de profundidad donde la temperatura es de 5,00 ºC y la presión es de 12,0 atmósferas, sabiendo que su volumen inicial era de tan solo 3,00 mm3. Asuma la cantidad de aire no cambia a medida que la burbuja sube, que el aire se comporta como un gas ideal, y que en la superficie la temperatura es de 25,00 ºC.
Solución: éste es problema en el que se tiene un estado final y uno inicial, y en el que la única variable que permanece constante es la cantidad de aire, así que los más conveniente es utilizar la ley combinada para resolverlo. Primero, conviene extraer todos los datos de forma ordenada y efectuar cualquier conversión para hacer más fácil la resolución del problema. Como la burbuja termina a nivel del mar, la presión final es de 1,00 atm:
| Estado Inicial | Estado Final | ||||
| Pi | = | 12,0 atm | Pf | = | 1,00 atm |
| Vi | = | 3,00 cm3 | Vf | = | ? |
| ni | = | nf = ? | nf | = | ni = ? |
| Ti | = | 5,00 ºC = 278,15 K | Tf | = | 25,00 ºC = 298,15 K |
Ahora, aplicando la ley combinada de los gases, y notando que los moles iniciales y finales se cancelan ya que son iguales (permanecen constantes) entonces:
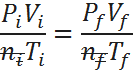
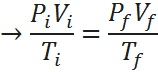
De la ecuación anterior, lo único que no se conoce es el volumen final, así que resolvemos la ecuación para dicha variable, sustituimos y listo:
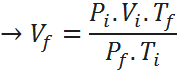
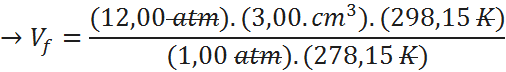
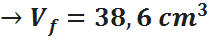
Así que el volumen final de la burbuja será de 38,6 cm3.
Ejemplo 2
¿En qué proporción cambiará la presión dentro de un reactor si simultáneamente se inyecta el triple de la cantidad inicial del gas, se reduce su volumen a la cuarta parte y se calienta desde 27 ºC hasta 327 ºC?
Solución: una manera de resolver este problema es por medio de la ley combinada de los gases. Primero, escribamos las relaciones entre las variables del estado inicial y final tal como se presenta en el enunciado:
- Si ni es la cantidad inicial del gas, entonces los que se inyecta es 3ni. Por lo tanto, al final, la cantidad de gas que habrá será nf = ni +3ni = 4ni.
- Si se reduce el volumen a la cuarta parte, eso significa que Vf = ¼Vi
- Finalmente, las temperaturas inicial y final son 300 K y 600 K, respectivamente. De aquí se puede deducir que Tf = 2Ti.
Ahora, para obtener el porcentaje, basta con hallar la relación entre la presión final e inicial, lo cual se obtiene fácilmente de la ley combinada:
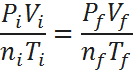
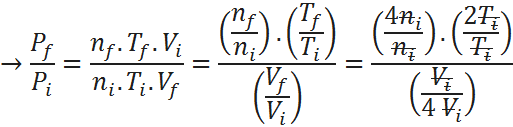
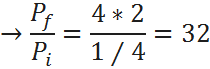
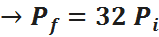
Por lo tanto, la presión aumentará hasta 32 veces su valor original.



