Tabla de Contenidos
Los átomos se componen de un núcleo, formado por neutrones y protones, y electrones que orbitan alrededor del núcleo. Las trayectorias que describen los electrones, los lugares del espacio del átomo por dónde se desplazan, constituyen un aspecto fundamental en las reacciones químicas y en las estructuras atómicas y moleculares que conforman. Los lugares del espacio de los átomos por dónde transitan los electrones son los orbitales. El orbital más sencillo es el del único electrón que tiene el átomo de hidrógeno, que es esférico. Pero a medida que los elementos tienen mayor cantidad de electrones, los orbitales por los que se desplazan son cada vez más complejos, hasta llegar al caso del uranio, que tiene 92 electrones, y que es el elemento natural con mayor cantidad de electrones.
La mecánica cuántica y los electrones de los átomos
La forma de los orbitales así como otras propiedades de los electrones de los átomos son descritas por la mecánica cuántica, que establece que parámetros físicos como la energía y la posición tienen valores definidos; no son parámetros continuos como en la mecánica clásica, en la que pueden tener cualquier valor. Por lo tanto, la energía de los electrones, al igual que los lugares por los que transitan en el espacio de los átomos, sólo pueden tener valores definidos.
La energía y la posición de un electrón orbitando alrededor del núcleo de un átomo se describe mediante una función matemática llamada función de onda, que es una solución de la ecuación de Schrödinger. Esta función representa la probabilidad de que el electrón pueda encontrarse en una determinada posición en un cierto momento. Y hablamos ahora de probabilidad porque la mecánica cuántica también establece que no es posible determinar en forma exacta dos parámetros físicos de una partícula como el electrón, como la energía y el tiempo, o la posición y el momento (cantidad de movimiento: el producto de su masa por su velocidad) de la partícula.
Los números cuánticos
La función que representa la probabilidad de que el electrón pueda encontrarse en una determinada posición en un cierto instante es el producto de cuatro funciones: tres asociadas a la posición del electrón (una dependiente de la distancia al núcleo del átomo y las otras dos dependientes de sus coordenadas angulares) y la restante asociada a la rotación del electrón. Estas funciones incluyen lo que se denomina números cuánticos, que son cuatro:
- El número cuántico principal n, asociado a la energía del electrón y que tiene valores enteros positivos.
- El número cuántico azimutal l, asociado al momento angular del electrón (cantidad de movimiento angular: el producto de su masa por su velocidad de rotación) que se expresa en letras; s para l=0; p para l=1, d para l=2, f para l=3. La nomenclatura del número l con letras tiene su origen en el estudio de los espectros de los metales alcalinos, en los que las líneas espectrales se agrupaban, por su nombre en inglés, en sharp (bien definidas, s), principal (principales, p), diffuse (difusas, d) y fundamental (fundamentales, f).
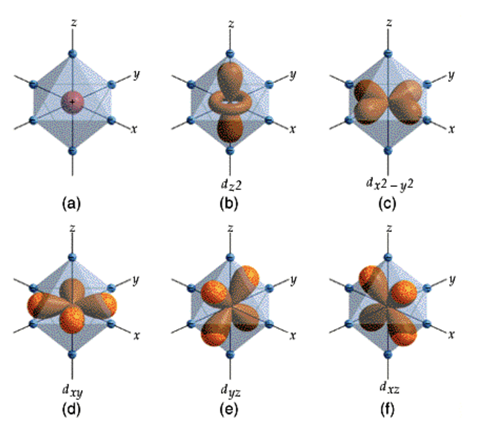
- El tercero es el número cuántico es el magnético m ó ml asociado a la orientación del momento angular del electrón. La variación de éste número cuántico produce, por ejemplo, las cinco distribuciones lobulares de los elementos que tienen orbitales 3d que se muestran en la figura. Está distribución de los electrones es muy importante, ya que corresponde a elementos que componen diversos materiales presentes en nuestra vida cotidiana, los metales de transición cromo, cobalto, cobre, hierro, níquel, manganeso, escandio, titanio y vanadio. En el caso de los niveles s, el número cuántico magnético ml sólo permite orbitales esféricos (ver la figura); en los niveles p permite tres formas de orbitales y en los f permite 7 formas de orbitales.
El cuarto número cuántico es el ms, el spin del electrón, asociado a su rotación.
La estructura electrónica de los átomos
La estructura de los electrones de cada elemento se constituye siguiendo la progresión de los números cuánticos, en función de las condiciones que conlleva cada uno. La progresión es la siguiente (el número entero es el número cuántico principal n y la letra el número cuántico azimutal l):
1s, 2s, 2p, 3s, 3p, 4s, 3d, 4p, 5s, 4d, 5p, 6s, 4f, 5d, 6p, 7s, 5f
Además hay que considerar que cada orbital puede contener hasta dos electrones con spin opuesto, por lo que los niveles s pueden tener hasta 2 electrones; los niveles p, que tienen 3 orbitales permitidos por el número cuántico magnético ml, pueden tener hasta 6 electrones; los niveles d, que tienen 5 orbitales permitidos (ver la figura), pueden tener hasta 10 electrones, y los niveles f, que tienen 7 orbitales permitidos, pueden tener hasta 14 electrones.
Siguiendo éste criterio, el hidrógeno (H), que tiene un solo electrón, tendrá una estructura 1s1, donde el superíndice 1 indica que hay un solo electrón en el orbital 1s. El helio (He), con dos electrones, tendrá una estructura 1s2 (dos electrones en el orbital s). El litio (Li), con tres electrones, tendrá una estructura electrónica 1s22s1. Y así sucesivamente. El hierro (Fe), por ejemplo, que tiene 26 electrones, tendrá una estructura electrónica 1s22s22p63s23p63d64s2; todos y cada uno de los 26 electrones del hierro transiratán los orbitales que establece ésta estructura electrónica.
NOTA
Hay que tener en cuenta que aunque la palabra orbital sugiere el concepto de «órbita», los electrones en realidad, y pese a los modelos atómicos iniciales, no se mueven alrededor del núcleo realizando órbitas, sino que «transitan» de un orbital a otro, cuando el átomo tiene más de uno, o permanecen en el único orbital del átomo (caso del hidrógeno y el helio), o pasan al un orbital compartido por los átomos que forman un enlace químico covalente.
Fuentes
E. Pavarini, E. Koch, F. Anders, and M. Jarrell. Crystal-Field Theory, Tight-Binding Method and Jahn-Teller Effect. Correlated Electrons: From Models to Materials Modelling and Simulation Vol. 2. Forschungszentrum Jülich, 2012, ISBN 978-3-89336-796-2.
J.J. Murrell, S.F.A. Kettle, J.M. Tedder. The Chemical Bond. Second Edition. John Wiley & Sons. 1985.
Roger G. Burns. Mineralogical Applications of Crystal Field Theory. Second Edition. Cambridge University Press. 1993.
Martín González Soto. Qué son los números cuánticos, NANOVA https://www.google.com/url?sa=t&rct=j&q=&esrc=s&source=web&cd=&cad=rja&uact=8&ved=2ahUKEwi22f7M3IT2AhWEjaQKHTpjDiAQFnoECEwQAQ&url=https%3A%2F%2Fnanova.org%2Fque-son-los-numeros-cuanticos%2F&usg=AOvVaw3UoxJOhbgXxBBSGz6R6zxr



