Tabla de Contenidos
Todos alguna vez hemos visto cómo los cubos de hielo se derriten al introducirlos en agua o en algún otro líquido. También hemos visto cómo un hielo puesto sobre una mesa lentamente se convierte en un pequeño charco de agua fría. Pero ¿en cuál de los dos casos se derrite más rápidamente?
El presente artículo busca ilustrar algunos conceptos importantes acerca de la transferencia de calor a partir del análisis de uno de los fenómenos de fusión más comunes a los que estamos expuestos en nuestras vidas diarias: el derretimiento de un cubo de hielo.
Para nuestro análisis, comencemos por definir algunos conceptos importantes.
El proceso de fusión
El derretimiento de un cubo de hielo es un proceso físico de cambio de fase en el que el agua pasa de estado sólido al estado líquido. Este tipo de cambio de fase se denomina fusión y es un proceso endotérmico. Esto último significa que el hielo debe absorber calor para poder derretirse; o sea, debe romper las fuerzas intermoleculares que mantienen firmemente unidas a las moléculas de agua en el hielo.
Este proceso se puede representar por medio de la siguiente ecuación:
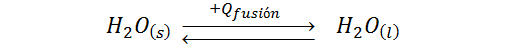
Donde Qfusión es el calor que el agua debe absorber para derretirse.
Como se puede ver, lo único que se necesita para derretir el hielo es calor. Por ello, para determinar cuándo se derrite más rápido el hielo, si en el agua o en el aire, lo que realmente debemos preguntarnos es en qué situación puede el hielo absorber calor más rápidamente.
Variables que afectan el proceso de fusión
La fusión es un proceso que depende de varios factores como la temperatura, la presión y la presencia de solutos en el líquido.
La temperatura de fusión
En primer lugar, este cambio de fase ocurre o se observa a una temperatura particular denominada punto de fusión. Lo que esto quiere decir es que, para que una sustancia se encuentre en estado sólido, debe estar a una temperatura inferior a su punto de fusión.
Lo inverso también es cierto. Siempre que veamos una sustancia en estado sólido (como el hielo) que no se esté derritiendo, podemos estar seguros de que está a una temperatura por debajo de su punto de fusión. Para poder derretirlo, primero debemos calentar el sólido hasta su punto de fusión, y luego aportar más calor para así poder derretirlo.
Esto tiene una implicación importante con respecto a nuestro problema: al plantearnos dónde se derretirá más rápido un hielo debemos asegurarnos de que en ambos casos los hielos en cuestión se encuentren a la misma temperatura inicial. De lo contrario, se necesitará más calor en uno de los casos para llevar al hielo a su punto de fusión.
Efecto de la presión
El punto de fusión de la mayoría de los sólidos aumenta con la presión, pero, en el caso del agua, sucede justo lo contrario. Esto se debe a una propiedad anómala del agua y es que, a diferencia de la inmensa mayoría de las sustancias puras, el agua en estado sólido (i.e. el hielo) es menos densa que el agua líquida.
Lo anterior hace que un aumento de la presión ayude a transformar al hielo en agua (que esta tiene un volumen específico menor). Por ello, se requiere menos energía térmica para separar las moléculas de agua y derretir el hielo, y este se derrite a una temperatura menor (es decir, más fácilmente).
Efecto de solutos
Por otro lado, la presencia de solutos o impurezas disueltas en un líquido también es un factor que afecta el punto de fusión. De hecho, se trata de una propiedad coligativa de las soluciones denominada descenso crioscópico o descenso del punto de fusión.
En virtud de estos dos factores que pueden afectar el punto de fusión del agua y que, por lo tanto, pueden afectar qué tan rápido se derrita un cubo de hielo en tal o cual medio, debemos asegurarnos de continuar el análisis asegurando que en ambos casos estemos tratando con agua completamente pura y libre de cualquier soluto. También debemos velar porque en ambos casos la presión atmosférica sea la misma y permanezca constante. Esto facilitará enormemente el análisis del problema para poder así centrarnos en la única variable que nos interesa: que el hielo esté rodeado de agua líquida o el aire.
Mecanismos de transferencia de calor
Ya aclaramos que para que un hielo se derrita necesita absorber calor de sus alrededores. Este calor primero cumplirá el papel de calentar al cubo de hielo hasta su punto de fusión, y luego para llevar a cabo el proceso de fusión propiamente.
Si partimos de dos cubos de hielo del mismo tamaño, forma y masa, formados por agua completamente pura y que se encuentran a la misma temperatura inicial, entonces ambos hielos requerirán exactamente la misma cantidad de calor para poder derretirse.
Por lo tanto, lo que debemos analizar es de dónde podrá el hielo absorber calor más rápidamente: del aire o del agua líquida. Para ello, debemos comprender las distintas formas como se puede transferir el calor, que son: convección, conducción y radiación.
La conducción del calor
Este mecanismo de transferencia es el que ocurre por contacto directo entre las partículas que forman dos cuerpos (o dos sistemas termodinámicos) que se encuentran a temperaturas distintas. Es el tipo de transferencia que ocurre cuando nos quemamos las manos al tocar una sartén caliente, por ejemplo. También es el tipo de intercambio de calor que ocurre entre el hielo y el agua o entre el hielo y el aire.
La velocidad de conducción de calor depende de varios factores. Entre ellos están la superficie de contacto, el gradiente de temperatura (es decir, la diferencia de temperatura entre dos puntos dividido entre su distancia) y la conductividad térmica del medio (que no es otra cosa que una medida de qué tan bien conduce el calor un material).
De todas estas variables, nosotros podemos controlar la superficie de contacto asegurándonos de que ambos hielos tengan la misma forma y las mismas dimensiones. Podemos también controlar el gradiente de temperatura al controlar la temperatura inicial tanto de los hielos como del agua y del aire. Sin embargo, la conductividad térmica sí será diferente en el caso del aire y del agua.
La convección
La convección es un fenómeno que se da en fluidos como los líquidos y los gases. Consiste en el movimiento de partículas del fluido que están a una temperatura hacia zonas donde la temperatura es diferente. La convección puede ser natural si el movimiento se genera por diferencias en la densidad ocasionadas por las diferencias en temperatura, o se puede producir de forma mecánica como cuando se sopla la comida caliente.
La radiación
Finalmente, toda superficie emite energía en forma de radiación electromagnética. Por ejemplo, el fuego es capaz de calentarnos con su brillo así no entremos en contacto con el aire caliente que emana por convección.
Entonces, ¿dónde se derrite el hielo más rápidamente?
Ahora ya tenemos todas las herramientas para responder esta pregunta. Para simplificar al máximo el análisis, vamos a asegurarnos de mantener constantes todas aquellas variables que pueden afectar la fusión del agua y quedarnos solo con aquellas que dependen del aire y del agua directamente.
Partimos de dos cubos de hielo idénticos hechos de agua pura, con la misma forma y el mismo tamaño; ambos se encuentran a la misma temperatura inicial. Sumergimos uno en un recipiente grande con agua que está a la misma temperatura del aire, y el otro lo colocamos encima de una superficie aislante térmica en contacto con el aire. Hacemos todo el experimento en un cuarto cerrado donde no existen corrientes de aire, minimizando todas las formas de transferencia de calor excepto la conducción.
Además, la conducción vendrá determinada principalmente por el material del medio; en ambos casos el gradiente de temperatura será esencialmente el mismo y la superficie de contacto también, por lo que la velocidad de transferencia de calor, y por lo tanto, la velocidad con la que se derretirán los hielos, dependerá principalmente de la conductividad térmica del medio.
Como el agua conduce el calor casi 30 veces más rápido que el aire, el hielo se derretirá más rápidamente en el agua.
Factores adicionales a considerar
Cabe resaltar que lo expuesto anteriormente no representa un análisis profundo y detallado del problema. Por ejemplo, no se está considerando el hecho de que el hielo flota en el agua, por lo que una parte del mismo estará expuesto al aire y no estará en contacto térmico con el agua.
Lo mismo sucede con el hielo que está en el aire, ya que necesariamente debe estar apoyado sobre alguna superficie, por lo que una de sus caras no estará en contacto con el aire sino con dicha superficie. Si la conductividad térmica de esta superficie es mayor que la del aire, el hielo absorberá calor más rápidamente por esta superficie, derritiéndose más rápidamente.
Además, al derretirse, aumenta la superficie del hielo derretido (es decir, agua) en contacto con la superficie, exacerbando el efecto.
A pesar de esto, se puede estimar que estos efectos serán menores al compararlos con la gran diferencia entre las conductividades térmicas del agua y el aire.
Referencias
- Connor, N. (2020, 8 enero). ¿Qué es la conductividad térmica del agua y el vapor? – Definición. Recuperado de https://www.thermal-engineering.org/es/que-es-la-conductividad-termica-del-agua-y-el-vapor-definicion/
- Laplace.us. (s. f.). Propiedades del agua. Recuperado de http://laplace.us.es/wiki/index.php/Propiedades_del_agua
- MINEDUC. (2019). Transferencia de calor. Recuperado de https://www.mineduc.gob.gt/DIGECADE/documents/Telesecundaria/Recursos%20Digitales/3o%20Recursos%20Digitales%20TS%20BY-SA%203.0/CIENCIAS%20NATURALES/U9%20pp%20210%20transferencia%20de%20calor.pdf
- Thermtest Instruments. (2020, 28 agosto). Materiales térmicamente conductores y aplicaciones comunes. Recuperado de https://thermtest.com/latinamerica/materiales-termicamente-conductores-y-aplicaciones-comunes



