Tabla de Contenidos
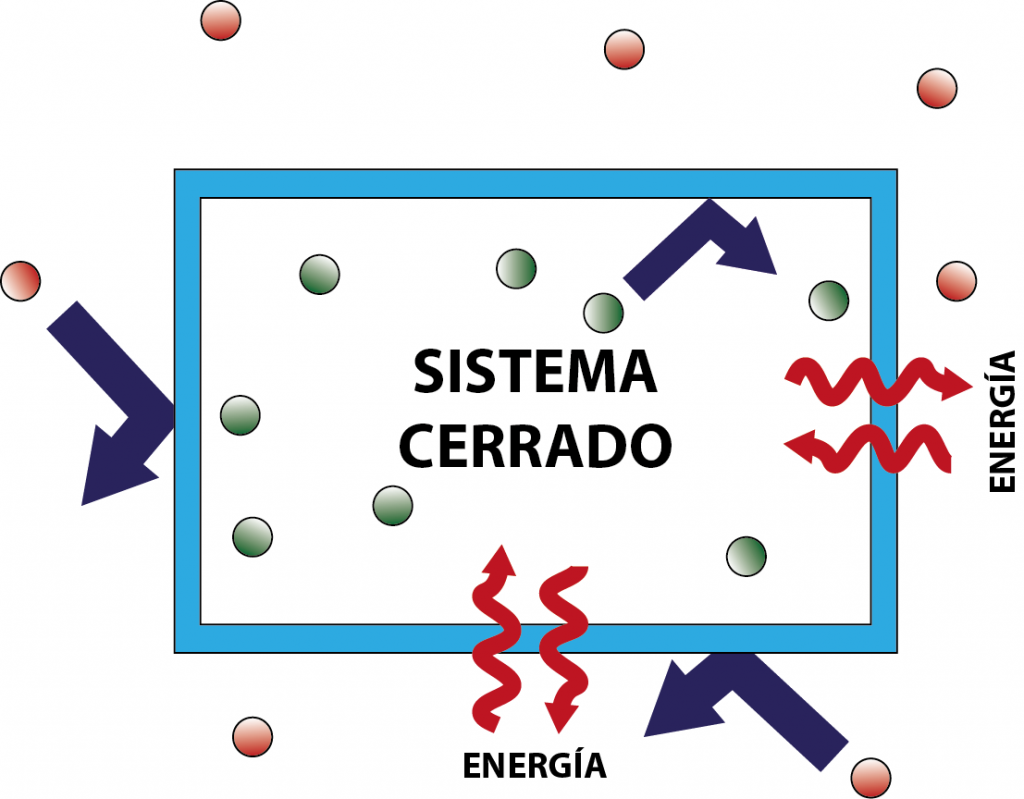
En termodinámica, un sistema cerrado es aquel que no intercambia materia con los alrededores, pero que sí puede intercambiar energía en distintas formas. En otras palabras, es un sistema cuyas fronteras no dejan que entren o salgan átomos ni moléculas, pero a través de las cuales sí puede pasar la energía buen sea en forma de luz, calor, trabajo, etcétera.
Los sistemas termodinámicos en general son modelos conceptuales que se utilizan principalmente para simplificar la descripción matemática de sistemas reales. En este sentido, los sistemas perfectamente cerrados en realidad no existen, ya que tendrían que ser totalmente herméticos y es casi imposible evitar que, aunque sea un puñado de átomos atraviesen la barrera que separa al sistema de los alrededores.
Sin embargo, son muchos los sistemas lo suficientemente herméticos como para ser considerados cerrados, y analizar y comprender adecuadamente dichos sistemas permite comprender muchos de los conceptos más fundamentales de la termodinámica. Esto último se debe a que los sistemas cerrados permiten “observar” el efecto que sobre un sistema tiene el flujo de energía desde y hacia el mismo, sin añadir la complicación de otras interacciones provenientes del intercambio de materia.
Características de los sistemas cerrados
Los sistemas cerrados tienen algunas características que los distinguen de los otros dos tipos de sistemas considerados en termodinámica:
- No intercambian materia con los alrededores.
- Son sistemas en los cuales se conserva la materia.
- Están rodeados por paredes o fronteras diatérmicas.
- Sí intercambian energía con los alrededores.
- Pueden tener paredes tanto rígidas como flexibles, siempre y cuando en ningún caso se permita el flujo de materia de un lado al otro.
- Interactúan con los alrededores por medio del intercambio de energía.
- Son sistemas que pueden hacer trabajo hacia los alrededores o recibir trabajo de los alrededores.
Ejemplos de sistemas cerrados
A pesar de que, como se mencionó anteriormente, los sistemas perfectamente cerrados no existen, sí existen muchos ejemplos de sistemas reales que, a efectos prácticos, se consideran cerrados.
Ejemplo 1: Un refresco cerrado.

Una botella de bebida gaseosa está lo suficientemente sellada como para evitar el escape del dióxido de carbono, incluso estando este a presión. Sin embargo, es evidente que las paredes de la lata o de la botella permiten el flujo de calor ya que los refrescos se enfrían en la nevera y se vuelven a calentar si se dejan afuera.
Ejemplo 2: Una olla de presión, antes de silbar.
Las ollas de presión son frecuentemente citadas como ejemplos de sistemas cerrados, y en realidad lo son. Durante el calentamiento inicial, la olla está cerrada herméticamente y no permite que entre o salga ni aire ni vapor de agua. Por otro lado, es evidente que sí está entrando energía en forma de calor, ya que tanto la olla como su contenido, lentamente se van calentando.

Es importante recalcar, sin embargo, que esto solo es cierto mientras esté cerrada la válvula (es decir, mientras la olla no esté pitando). Cuando la presión interna de la olla supera la presión que ejerce la válvula y esta se abre, el vapor y los demás gases que se encuentran a alta presión en el interior de la olla escapan a alta velocidad. Esto representa un intercambio de materia con los alrededores.
Ejemplo 3: Bolsa de aperitivos sin abrir.

Las bolsas de frituras y aperitivos también representan un buen ejemplo de un sistema cerrado. Además de no permitir la entrada o salida de aire u otras sustancias, y además de permitir el paso de energía en forma de calor, también permiten el flujo de energía en forma de trabajo a través de la bolsa. Como muestra de esto está el hecho de que podemos partir las frituras con nuestras manos a través de la bolsa, sin necesidad de abrirla. Para romper o deformar un material (como una papa frita, por ejemplo) es necesario realizar trabajo, así que nosotros (actuando como los alrededores) estamos efectivamente haciendo trabajo sobre el interior del sistema (conformado por las frituras dentro de la bolsa).
Ejemplo 4: Alimentos enlatados.
Los alimentos enlatados son todos ejemplos de sistemas cerrados. Es evidente que el contenido de las latas prácticamente no intercambia ninguna sustancia con los alrededores.

Dentro de las latas pueden estar ocurriendo reacciones químicas o distintos tipos de procesos biológicos que pueden estar transformando la materia del contenido, pero, sin importar lo que esté pasando adentro, la masa de su interior permanece constante.
Ejemplo 5: Carnes selladas al vacío.

Las carnes y otras proteínas se suelen conservar al empacarlas al vacío dentro de bolsas plásticas gruesas que se sellan herméticamente. Este también es un ejemplo de un sistema cerrado. De hecho, en algunos casos, las carnes son adobadas antes de sellarlas y se pueden incluso cocinar dentro de los mismos paquetes, permitiendo el flujo de calor que cocina la carne, pero evitando que se pierdan los jugos que le dan su exquisito sabor.
Referencias
Atkins, P., de Paula J. (2014). Atkins’ Physical Chemistry. (Ed. rev.). Oxford, United Kingdom: Oxford University Press.
Brown, T. (2021). Química: La Ciencia Central. (11ava ed.). Londres, Inglaterra: Pearson Education.
Chang, R. (2008). Fisicoquímica (1.a ed.). New York City, New York: McGraw Hill.
Laws of thermodynamics (s.f.). Recuperado de https://www.khanacademy.org/
Basic Definitions – System and Surroundings. (2020, August 13). Recuperado de https://chem.libretexts.org/@go/page/53093



