Tabla de Contenidos
El enlace Pi, o enlace ∏, es un tipo de enlace covalente en el que dos átomos vecinos comparten un par de electrones a través de orbitales atómicos que son paralelos entre sí. En la mayoría de los casos, ambos orbitales involucrados son orbitales p, pero también pueden formarse enlaces pi entre dos orbitales d e incluso entre orbitales p y d.
A diferencia de los enlaces σ (sigma), en los que el solapamiento de los orbitales atómicos es frontal, en los enlaces pi los orbitales se solapan lateralmente, dando origen a un orbital pi enlazante y a uno antienlazante. En este tipo de enlace, hay dos electrones ocupando el orbital pi enlazante. Ambos electrones pueden provenir de uno de los dos átomos, o cada átomo puede contribuir con un electrón desapareado. A estos electrones se les denomina electrones π.
El orbital enlazante del enlace pi posee dos lóbulos que se extienden entre los átomos enlazados, uno por encima y otro por debajo de un plano perpendicular a los orbitales atómicos originales.
La razón por la que se denomina enlace ∏ (que es la letra p del alfabeto griego) es que, al mirar este enlace a lo largo del eje que une a los dos átomos, los dos lóbulos del orbital ∏ se asemejan mucho a la forma de los orbitales atómicos p.
Los enlaces pi siempre están presentes en los enlaces múltiples. En los compuestos orgánicos, siempre que se tenga un enlace doble o un enlace triple, se tendrá un enlace sigma y el resto serán enlaces pi. Por ejemplo, en el enlace triple hay un enlace sigma y dos enlaces pi que se forman por el solapamiento entre los orbitales py y pz de uno de los átomos con el respectivo orbital py y pz del otro.
Características de los enlaces pi
Son más débiles que los enlaces sigma
El hecho de que los orbitales que forman el enlace pi se solapen de forma lateral en lugar de frontalmente, hace que el solapamiento sea débil. Además, la densidad electrónica en el orbital pi, está en promedio más alejada de los núcleos de los átomos enlazados. Por estas dos razones, estos enlaces son más débiles y fáciles de romper que los enlaces sigma.
NOTA: Que este enlace sea más débil que el enlace sigma, no quiere decir que un enlace doble sea más débil que uno simple. De hecho, sucede justo lo contrario, ya que, para romper un enlace doble, se debe romper tanto un enlace sigma como uno pi.
Son enlaces rígidos
La condición esencial para que se pueda formar este tipo de enlace es que existan en los átomos adyacentes orbitales paralelos entre sí, sean estos orbitales p o d. La rotación del enlace en torno a su eje, haría que los orbitales atómicos ya no estuvieran en una configuración paralela, lo que rompería el enlace. Por esta razón, es muy difícil rotar o doblar estos enlaces sin romperlos. Esto hace que los enlaces pi sean muy rígidos comparados a los enlaces simples que tienen libertad rotacional y que son bastante flexibles.
Se pueden conjugar con otros enlaces pi
Si dos átomos poseen un enlace pi entre ellos y existen otros átomos adyacentes que también poseen orbitales p que sean paralelos a los primeros, el solapamiento de todos estos orbitales forma lo que se llama un sistema pi conjugado. En estos sistemas, los electrones pi pueden moverse libremente de un lado a otro en lugar de estar localizados en una sola región del espacio. Por esta razón, se dice que estos electrones están deslocalizados.
Ejemplos de compuestos con enlaces Pi
Son incontables los ejemplos de compuestos que poseen este tipo de enlace covalente. A continuación, se presentan algunos ejemplos en los que además se indica los orbitales atómicos que se solapan para formar cada enlace.
Ejemplo 1: Etileno (C2H4)
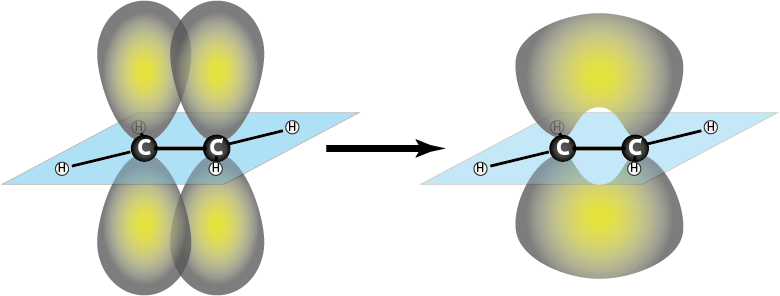
En etileno o eteno es un alqueno que posee un enlace doble carbono-carbono. Este enlace doble está formado por un enlace sigma y un enlace pi entre dos átomos de carbono con hibridación sp2. Le enlace pi se forma entre los dos orbitales pz de los átomos de carbono, así que es un enlace πpz-pz.
Ejemplo 2: Dióxido de carbono (CO2)
En el caso del dióxido de carbono, los dos oxígenos tienen hibridación sp2 mientras que el átomo central de carbono tiene hibridación sp, dejando dos orbitales p puros, el py y el pz.
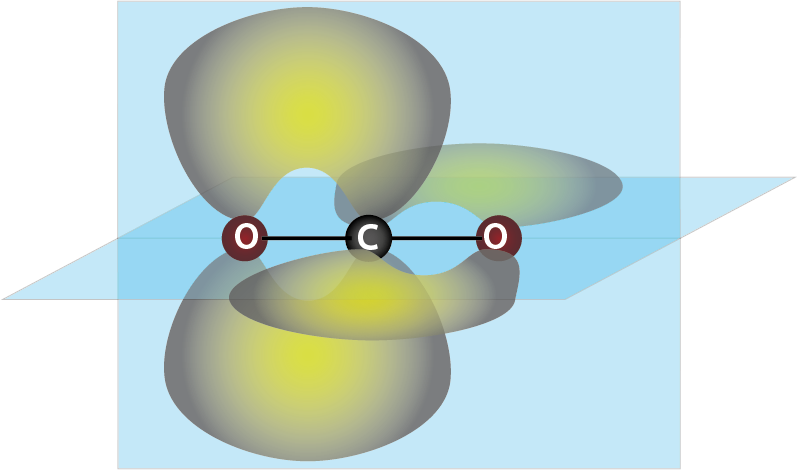
Así que el carbono forma dos enlaces pi, uno con un oxígeno, y otro con el otro. El primero sería un enlace πpz-pz y el otro sería πpy-pz. Ambos enlaces pi se encuentran en planos perpendiculares uno con el otro, ya que los orbitales py y pz son perpendiculares entre sí.
Ejemplo 3: Propanonitrilo (CH3CH2CN)
Este compuesto posee un enlace triple C-N. En este caso, el enlace triple se puede imaginar como un enlace sigma y dos enlaces pi perpendiculares entre sí entre el carbono y el nitrógeno. Tanto el carbono como el nitrógeno presentan hibridación sp, dejando libres los orbitales py y pz que son los que forman los dos enlaces pi.
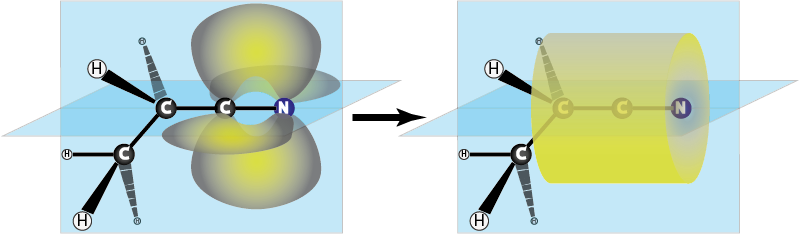
Cabe resaltar que, en el caso de los enlaces triples, en lugar de dos pares de lóbulos a sendos lados del enlace sigma, los dos enlaces pi se combinan para formar un solo lóbulo cilíndrico de densidad electrónica concéntrico con el eje que une a los dos átomos.



